Del 1 er en lille forsmag inden vi dykker ind i kødet af denne blogserie som først starter i del 2-5.
Understående er en gennemgang af hvilke patienter vi skal overveje AKS ved, og er opdelt på følgende emner
- Atypiske AKS patienter: De patienter vi misser AKS på
- Brystsmertepatienten – differentialdiagnoser: Alle med brystsmerter har ikke AKS
- AKS patienten med brystsmerter: Hvad er vigtigst at få med i den kliniske bedømning
- Før vi overvejer AKS: Vi skal ikke udrede for AKS, hvis vi ikke mistænker det
- Kombinationen af begge verdener: Vi behøver både Gestalt og system 2 tankegang
1. De atypiske AKS patienter er dem vi misser
Generelt virker det til, at miss-raten på OMI (okkluderende myokardie infarkt – se del 2 for detaljer) på akutmodtagelsen ved brystsmertepatienter med negativt EKG og biomarkører er 0,2%!!! (jf Justin Morgensterns analyse af Pope et al, 2000 – https://first10em.com/mi-miss-rate/ ). Det vil sige følger man udredningsproceduren, så er OMI-raten lav (0,2% -> 1:500) for patienter, der kommer med brystsmerter!
The rule for ACS presentations is: Atypical is typical
Det er de, AKS’er vi ikke overvejer (i.e som præsenterer atypisk), som vi misser
EMcases Ep128: Low risk chest pain
1/3 af patienter med AKS har ingen brystsmerter, men præsenterer med følgende symptomer i faldende hyppighed:
Dyspnø > generel svaghed > træthed > svedtendens > svimmelhed (i så fald oftest sEVT – spontan episodisk vestibulært syndrom uden nystagmus)
Høj risiko grupper for disse ”atypiske” OMI præsentationer, hvor du bør overveje at tage TnI og EKG, hvis ikke andre åbenlyse årsager findes, er
- Ældre (særligt fraile ældre med ”non-specific complaints”)
- Patienter med nerveskader (fx diabetikere og øvrige polyneuropati patienter) med anderledes nerveledning
- Patienter der ikke er i stand til at udtrykke sig (afasi, demens, psykiatriske, misbrugere)
- Kvinder i alle aldre
- Gravide kvinder
Som med alting atypisk, hvor vi ikke har gode studier, er dette en balancegang imellem: For meget udredning Vs underudredning, hvor problemet ofte er de ældre patienter, hvor blodprøverne er “mudrede” og på komplekse måder interagerer. Hér er det svært at se signal ud fra støjen af CRP, leukocytter m.m, og tærsklen for at tage mere end 1 troponin og EKG bør nok være lav, hvis du har (atypisk) klinisk mistanke (fx ældre patient der sveder, er svimmel eller dyspnøisk uden KOL eller infektion)
Gravide og post-partum kvinder ekskluderes ofte fra studierne som vi har vores “klassiske” AKS patient fra. Gravide skal du være særligt opmærksom på af flere årsager
- De har ofte benigne årsager til både smerter (refluks, muskelsmerte, psyko-sociale høj baseline belastning – se del 5) og dyspnø (graviditetsfysiologi) – derfor høj “støj”-ratio
- Radiologi er generelt sikkert, hvis du bare har høj mistanke (med få undtagelser fx gadolinium kontrast)
- Alt efter tidspunkt i graviditeten mere eller mindre øget for lungeemboli /DVT, som oftest præsenterer med dyspnø men udredningsalgoritmen og risk-benefit analysen er …kompliceret, hvis du ikke har høj mistanke (fx med DVT eller tidligere DVT’er)
- Gravide kan bl.a pga østrogen og oxytocin påvirkning få alvorlige komplikationer fra hjertet: Koronar-dissektion (ligesom de har øget risiko for halskarsdissektion), oxytocin induceret peri-myokardit der præsenterer som hjertesvigt
Så summa sumarum – vær ekstra grundig med de gravide (særligt peri-partum og post-partum 8 uger), lyt grundigt til historien og risikofaktorene, og konferer med bagvagt hvis du er i tvivl. Findes NOGET på EKG’et / troponiner for AKS / perimyocardit, eller har ud mistanke om lungeemboli på god grund, så vær ikke bange for at udføre CT angiografien af thorax – dog med shared decision making om risiko (brystvævsstråling – særligt hvis BRCA positiv / brystcancer historie; særligt ved 1. trimester) og benefit (alt efter din mistanke). En watchfull-waiting teknik er måske ikke helt tosset, ved lav risiko patienten som du dog overvejer lungeemboli på, hvis patienten går med.
2. Brystsmertepatienten (differentialdiagnoser)
Generelt er der altid 5-6 differentialdiagnoser vi må have i hovedet ved brystsmertepatienten. Deres sandsynlighed fordeler sig således på akutmodtagelse populationer
- AKS (10%)
- Lungeemboli (1-2%)
- Aortadissektion (<1%)
- Tamponade / perikardit / myokardit
- Pneumothorax
- Boerghave syndrom (oesophagus ruptur)
Denne blog fokuserer på AKS-patienten, og det er også hér (foruden lungeemboli og aortadissektion), at det meste litteratur på akutmodagelser findes.
For data om de øvrige patientgrupper anbefales følgende kilder (indtil blogs kan laves om dem engang også):
LE (Lungeemboli) – se cardio NBV
- Epi
- Cohen et al, 2013: Venous thromboembolism (VTE) in Europe
- Generelt
- EmCases Ep 113 + 114: Pulmonary Embolism part 1+2 (diagnostic, To PERC or not, diagnostic evaluation, pregnancy, risk stratification etc)
- St emlyns, 2015: VTE masterclass with Dan Horner
- Konstantinidis et al, 2019 (ESC): 2019 ESC Guidelines for the diagnosis and management of acute pulmonaryembolism developed in collaboration with the European Respiratory Society (ERS)
- BTS (British Thoracic Society), 2018: BTS Outpatient Management of Pulmonary Embolism Guideline
- Diagnostik og overdiagnostik
- D-dimer
- Nybo et al, 2018 (ugeskriftet): National guideline til aldersjusteret cut-off for fibrin D-dimerværdi ved diagnostik af venetrombose
- Approach
- Kline et al, 2014: EMERGENCY EVALUATION FOR PULMONARY EMBOLISM, PART 1+2: DIAGNOSTIC APPROACH
- Gestalt:
- Panaloza et al, 2013: Comparison of the Unstructured Clinician Gestalt, the Wells Score, and the Revised Geneva Score to Estimate Pretest Probability for Suspected Pulmonary Embolism
- Synkope og LE (debunked)
- St emlyns, 2019: Taking the PESIT – How Common is PE Among ED Patients with Syncope (syncope and PE)
- D-dimer
- Behandling og risk-stratification (who can go home?)
- Condliffe et al, 2014: Management dilemmas in acute pulmonary embolism
- St emlyns: Pulmonary embolism, ambulatory care and the goddess of the hunt
- St emlyns, 2018: We call it massiiiiiiivve. PE at st Emlyns
Aorta dissektion – se cardio NBV
- Generelt
- Evangelista, 2018: Insights From the International Registry of Acute Aortic Dissection
- Diagnostik
- George Willis, 2018: http://www.stemlynsblog.org/aortic-emergencies-with-george-wills-at-stemlynslive/
- EMcases Ep 92: Aortic Dissection https://emergencymedicinecases.com/aortic-dissection-em-cases-course/
- ACEP: How to Diagnose Aortic Dissection Without Breaking the Bank
- Gaul et al, 2008: Neurological Symptoms in Aortic Dissection: A Challenge for Neurologists
- JAMA 2013 (Klompas): Does This Patient Have an Acute Thoracic Aortic Dissection?
- http://www.emdocs.net/acute-aortic-dissection-3/
- https://coreem.net/journal-reviews/d-dimer-in-aortic-dissection/
Perikardit
- Dr Smiths ECG blog
- EmDocs, 2018: Pericarditis http://www.emdocs.net/em3am-pericarditis/
- EMU 365: Amal Mattu – killer ECG’s
3. AKS patienten med brystsmerter
Med fordel anvendes MAPELS, OPQRST+ eller SOCRATES anamnese-teknikken for at få indsamlet data om patientens symptomer. Som altid, anbefaler jeg stærkt, at man først stiller specifikke spørgsmål EFTER efter man har stillet et åbent spørgsmål og aktiv lyttet!
Anamnesen og helhedsindtrykket (gestalt) og i mindre grad objektiv undersøgelsen er essentiel ved brystsmertepatienten.
Det føles altid kunstigt at dele alle elementerne af hvad patienten fortæller, og hvad vi spørger om, op i enkelt-dele med hver deres værdi. Vi ved alle, at patientbedømmelser er “helhedsbedømmelser” (jf gestalt herunder). Følgende skal ikke tages som en facitliste, men snarere som en liste over ting, du skal være særligt opmærksom på ved brystsmertepatienten mhp AKS. På EMCC vil vi , bede dig tjekke en lignende tjekliste for at spørge specifikt ind til data-punkter, du måske har glemt. Min filosofi indenfor dette (der er anderledes end EMCC’s) er, at man ud fra gestalt, kommunikation, alliance m.m, er nødt til at anvende sådanne tjeklister som “do – confirm” (tal først, tjek derefter), i stedet for “read – do” (sid med hovedet i bogen og tjek af).
Uanset hvad man måtte mene, så er der en del data om hvad der øger- og sænker sandsynligeheden for AKS ved patienter med brystsmerter. Data er indsamlet fra følgende kilder
- JAMA evidence series: Does my have acute myocardial infarction?, 2009
- RCEM : Chest Pain Syndromes (tilgået nov 2019)
- Steve McGee: Evidence based physical diagnosis, 2017
- theNNT.com: Acute Coronary Syndrome (tilgået nov 2019)
- Trapid-AMI trial, 2018 (gratis tilgang hér)
- EmCases Ep 128
- Mokthari og Dryver 2015: Diagnostic values of chest pain history, ECG, troponin and clinical gestalt in patients with chest pain and potential acute coronary syndrome assessed in the emergency department
Der er flere caveats ved disse studier, og min metode til at høste deres oplysninger:
- Studierne ekskluderer ofte særligt vigtige grupper som gravide, nyresyge og CABG/PCI opererede indenfor 30 dage og “atypiske” præsentationer for AKS (jf herover)
- Jeg går ud fra, at patienterne er blevet set i akutmodtagelser – men settingen kan være anderledes i de enkelte studier
- Jeg høster de bedste resultater fra hver kilde. Ting, der blot er nævnt en eller to gange og har dårlige LR (dvs omkring 1) indgår ikke. Dette er en subjektiv vurdering fra min side, og jeg opfordrer folk til selv at gå ind og tjekke LR på kilderne herover
- Nuancer og helhedsbedømmelse forsvinder ofte i sådanne studier, da man bliver nødt til at lave en grænse for, hvad man bedømmer som “ST-depressioner” – selvom (som vi skal tale om i del 2), der findes klare nuanceforskelle
Uden videre forsinkelse, er resultatet hermed:
MAPELS / baggrunds information
Data, der øger sandsynligheden
- Alder >60 (LR 1,5) uanset risikofaktorer (evt diabetes) (McGee, Mokthari 2015)
- Alder <40 med risikofaktorer (Mokthari 2015): LR 0,02
- Tidligere MI LR 1,5-3 (JAMA)
- PAD LR 2,7 (TheNNT)
Data, der sænker sandsynligheden
- Alder <40 år (LR 0,2)
Flere eksperter rekommenderer fokus på følgende atypiske risikofaktorer
- Kokainmisbrug
- HIV
- Klassiske risikofaktorer for personer <40 år
- Graviditet
Mini-bottom line om risikofaktorer: Risikofaktorer betyder ikke meget (jf også HEART-scorens vægtning af dem), og med alderen “udhviskes” de pga den relativt højere alders-risikoen som trumfer over dem. Klassiske risikofaktorer (hypertension, diabetes, rygning) og atypiske risikofaktorer (jf herover) skal man være opmærksomme på ved den unge patient med brystsmerter, da dette kan være det udslagsgivende, som gør, at de må udredes for AKS. En sammenfatning af hvorfor risikofaktorer i en proabilistisk akutmedicinsk setting ikke virker overvældende vigtige, gives brilliant af Simon Carley:
OPQRST+ Anamnestisk information
Ting der øger sandsynligheden
- Smerte beskrevet som tryk (LR 1,3-4,6)
- Udstråling til begge arme (LR 2-4)
- Udstråling til ene eller anden arm (LR 1,5-3)
- Forværring ved træning (excersion) (LR 1,5-3)
Mere end ét symptom af overstående var i TRAPID-AMI studiet associeret med højere risiko
Data, der sænker sandsynligheden
- Pleuritiske brystsmerter (LR 0,35-0,65)
- Sudden onset (LR 0,75)
- Positional pain (værre ved særlige bevægelser) (LR 0,3)
- Inframamarisk position
- Fravær af
- Typiske brystsmerter (LR 0,52)
- Værre ved træning (LR 0,6-0,8)
Tegn, der øger sandsynligheden for AKS
- Tegn til hjertesvigt (én af følgende): JVP, pulmonary crackles, third heart sound, BT <100 – LR 2-3
- Sved / Diaphorese (LR 2)
- Vomit (LR 2)
Tegn, der sænker sandsynligheden for AKS
- Palpation reproducerer al smerte (LR 0,2-0,4)
Mini-bottom line om enkelt elementer i anamnesen: Patientens historie er mere end enkeltelementerne herover – det er en kunst at tage den, og er formentlig en af de vigtigste ting vi udfører som læger. De ting vi særligt skal spidse ører for ved AKS patienten, er udstråling (bilateralt > unilateralt – uanset side) og forværring. Meget som d-dimeren, øger enkelt-elementer i historien sjældent sandsynligheden særligt (fx ved patienten der BARE har udstråling og uspecifk brystsmerter), men vi er oftest nødt til at udføre EKG og tropnin på disse patienter for at sænke sandsynligheden tilstrækkeligt. Derimod er kombinationen af flere positive anamnestiske spontant oplyste symptomer og tegn noget der driver præ-test sandsynligheden op – måske så højt ved nogle, at PCI må kontaktes selv med normalt EKG og troponin (alt efter timinig).
Nogle patienter kan man formentligt sænke sandsynligheden for AKS ved betydeligt, ved kombination af flere anamnestiske symptomer med særlig lav LR: reproduktion af smerten (HELE SMERTEN!) ved palpation af thorax, forværring ved særlige bevægelser, pleuritiske brystsmerter, og ved fravær af “rule in” symptomer. Vi skal altid overveje aorta dissektion ved sudden pain, og i øvrigt overveje lungeemboli og pneumoni som differentialdiagnoser, hvis det ikke lyder som AKS (overvejelse betyder ikke udredning for dem dog! – hvis de er under en udredningstærskel jf “tærskelmodellen“)
Den kliniske undersøgelse ved patienten med brystsmerter er mindre vigtig ift at finde AKS, selvom nyopståede hjertesvigtstegn øger sandsynligheden lidt.
Paraklinik og HEART-score
EKG
- ST elevationer (LR+ >5-10) 15 i Mokthari et al
- ST depressioner (LR+ >3-5) – 11 i Mokthari et al
- T-taks inversioner (LR+ 2-3 – mere mod 3 hvis høje t-takker)
- Normalt EKG (LR+ 0,2) – obs beskriver ej tidspunkt fra smertedebut!. – 0,6 i Mokthari et al
Troponiner
- Høj sensitive troponiner, første hold positive: LR+ 15-41, LR- 0,5-0,7 (Motkhari et al)
Bedste sammenfatning af værdien af troponiner findes på EmCases:
Elevated troponin is not specific for myocardial infarction. One observational study of 615 patients with elevated troponin found that the overall positive predictive value for ACS was only 56%. However, troponin is an indicator of myocardial injury independent of cause.
EmCases Ep 128: Low Risk Chest Pain
An elevated troponin increases the risk of short-term MACE and death regardless of cause, whether from sepsis, pulmonary embolism, chronic kidney failure or heart failure
CDR’s (The NNT)
- HEART score <3 LR 0,2
- HEART score 4 LR 0,8
- HEART score 5-6 LR 2,4
- HEART score 7-10 LR 13
Ting som vi tror virker, men ikke har megen evidens
- Smertelindring på Nitro som diagnostisk markør for AKS (McGee)
- Gastric Coctail som reduktion af risko for AKS (McGee)
- Hand gestures (Levine sign, palm sign, arm sign, pointing sign) (McGee)
- Smertesværhedsgrad (EmCases)
Bottom line om parakliniske tests: Dette paradigme har nyligt ændret – se derfor del 2-5 for den dybe diskussion. Bemærk, at ST-elevationer har en LR i disse studier på >5-10 (mange med STEMI er altså falsk positive).
Sammenfatning om enkeltdelene i brystsmerte-anamnesen
Intet enkelt symptom eller tegn kan udelukke AKS, når du først har tænkt at patienten skal udredes (se herunder for gestalt). Tænker vi probabilistisk, er dette logiskt, når vi ser på at præ-test sandsynligheden for brystsmertepatienten for AKS er 10% på akutmodtagelse populationer, og LR for symptomer og tegn (herover). Ingen enkelt anamnestisk eller tegn eller paraklinisk fund, kan sænke sandsynligheden under de ”magiske” 1-2 % post-test sandsynlighed, som internationalt klassificeres inofficielt og nyligt også officielt (ACEP 2018), som acceptabel miss-rate på AKS.
Enkelt-elementerne i diagnostikken /angivet herover), har forskellig betydelse, alt efter oplysningerne indsamlet (præ-test sandsynligheden):
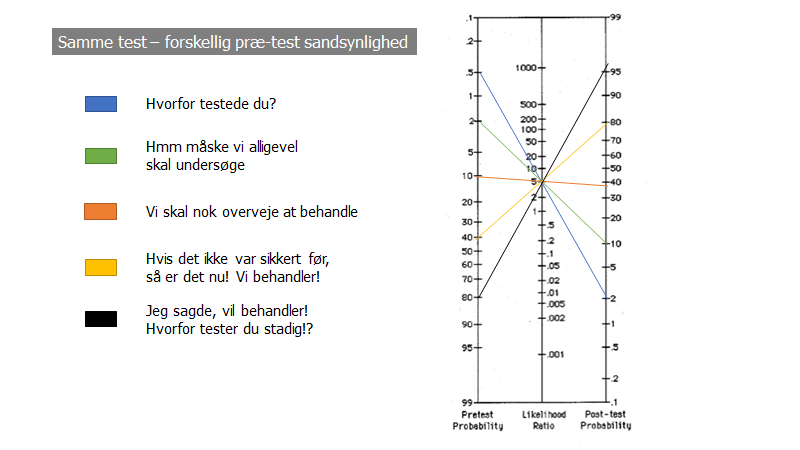
I fagans nomogrammet herover, har jeg indsat samme test med LR 5 (fx patienten har ST-depressioner på EKG’et).
Bemærk, at ST-depressioner bliver en “dikotomi”. Enten eller. Som vi taler om i del 2, er der selvfølgelig tydelige nuanceforskelle mellem nogle NSTEMI’er og andre
De er dog stærke, når de kombineres (bemærk – dette er en ren overslags-matematisk kombination, altså system 2-tænkning, og denne skal altid kombineres med system 1 og gestalt – jf herunder. Har du en “dårlig mavefornemmelse, så udred med troponiner også! – men har du ikke, så husk at overdiagnostik og overbehandling, samt somatisering er en plage, som vi kun kan løse ved at undlade at undersøge):
Går vi ud fra, at alle patienter starter på 10% præ-test sandsynlighed, når de bare nævner brystsmerter, og vi bedømmer det kan være AKS (jf gestalt herunder), så vil en ung person uden risikofaktorer (klassiske og atypiske) falde hurtigt falde ned til <2-5% post-test sandsynlighed. Er historien ikke foruroligende og kan man evt frempalpere hele deres smerte, er vi langt under 1-2% post-test sandsynlighed. Smider du et EKG ind bare fordi de sagde at det måske stråler ud til venstre arm, og EKG’et er normalt, så er vi stadig i en position, hvor de ikke behøver troponiner.
Ruling out by ruling in: Som en del af disse gennemgange, hvor vi fokuserer på ét illness script (AKS), glemmer vi ofte, at når sandsynligheden for den ene diagnose falder, stiger den sandsynligheden for alle andre diagnoser (forudsat, at patienten har én diagnose og ikke to diagnoser – såkaldt Hiccums Dictum). Da vores job som akutmedicinere er, at “sænke sandsynligheden for det tidskritiske”, glemmer vi desuden ofte, at “de farlige” diagnoser – selv de hyppigste – sjældent udgør mere end 10-20% af præ-test sandsynligheds-landskabet:
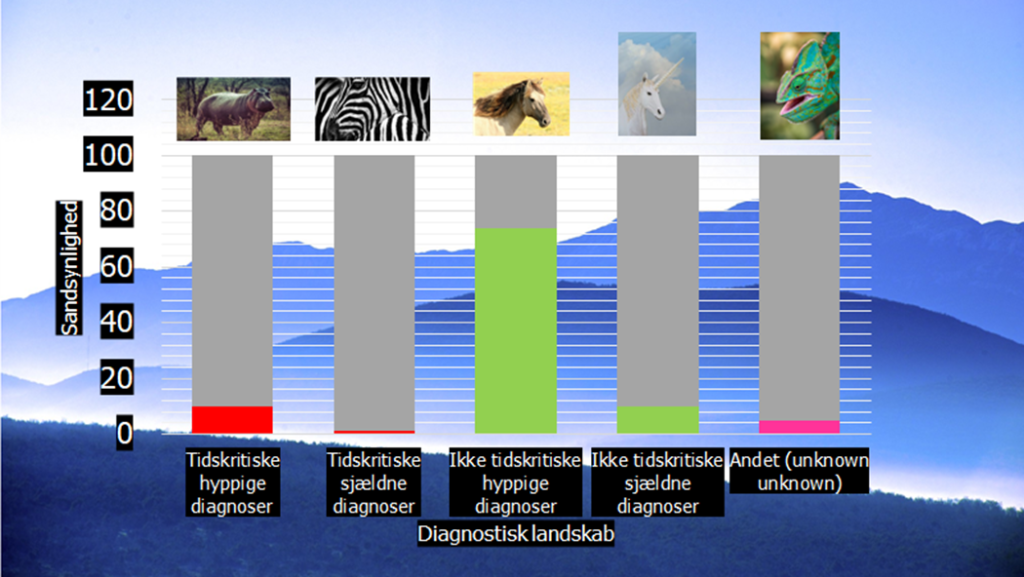
Laver vi et landskab for brystsmertepatienten og de diagnoser vi i starrten nævnte, at vi overvejede mest:
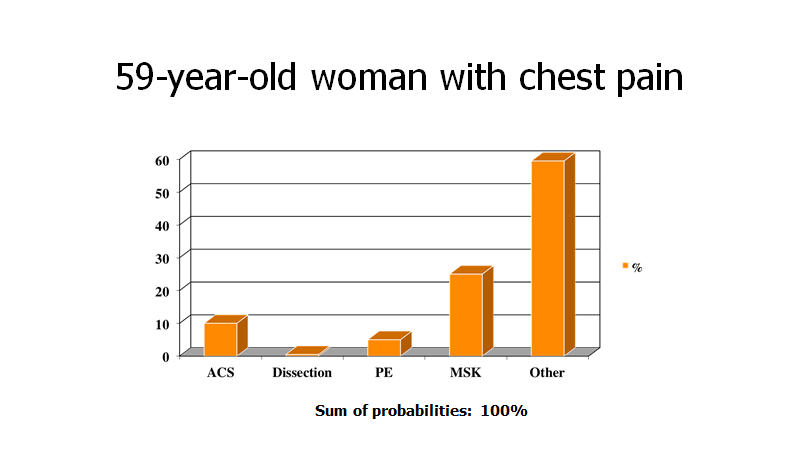
Er det første din patient fortæller dig, at hun har pleuritiske brystsmerter, ser landskabet pludselig anderledes ud
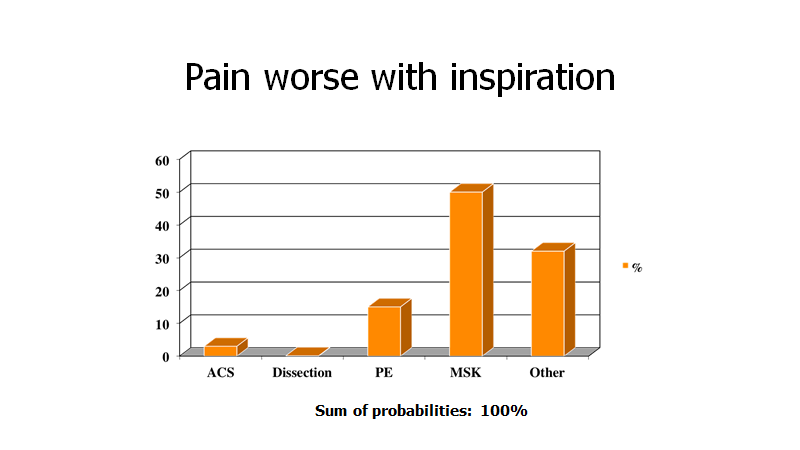
Dette et perfekt eksempel på, hvorfor patienter ikke har diagnoser, men kun sandsynligheder for dem; hvorfor vores kommunikationsevne er en test, og hvorfor (do-confirm) tjeklister kan være nyttige for at huske alle de vigtige datapunkter (selvom du ved dette spørgsmål får sandsynligheden for AKS ned på ca 2%, må du udføre en lidt grundigere historie. Mængden af “ting vi ikke har spurgt om”, er stor, og denne “pose” skal tømmes tilstrækkeligt inden det er OK at gå i en anden retning eller slippe mistanken)
Det er også et perfekt eksempel på, en af styrkerne ved akutmedicin. Differentialdiagnoserne tilhører forskellige specialer – vi (akutmedicinere) er den speciallæge, der skal kende til diagnostikken og initialbehandlingen af de alvorlige uanset speciale. Dette mindsker risikoen for “for en hammer er alting et søm“-problemet, hvor intern medicin / kardiolog specialisten udelukker AKS, men ikke går videre med resten af udredningen
Husk derfor også dine vigtigste differentialdiagnoser:
- Dyspnø ved gang og evt troponinslip (kan tyde både på AKS og LE – mere på LE end AKS alt efter demografi – jf EMcases Ep 113+114: PE challenges Part 1+2 – https://emergencymedicinecases.com/pulmonary-embolism-challenges-diagnosis-part-1/ )
- Sudden- og evt højintens onset chest pain (SAH of the thorax), brystsmerter der beskrives som ”skarp” eller ”skærende” og ”chest pain +1 symptom mere”-konceptet (skal give dig mistanke om aorta dissektion i stedet – jf EmCases Ep 92: Aortic dissection – https://emergencymedicinecases.com/aortic-dissection-em-cases-course/ )
Bottom line, om klinisk diagnostik (system 2): Intet enkelt-element i diagnostikken kan udelukke AKS. Dermed ment – “bare fordi” du frempalperer smerten som din 78 årige brystsmertepatient har, betyder det ikke “udelukket AKS” – heller ikke, hvis EKG’et er normalt, uden en anden bedre forklaring på brystsmerterne. Er patienten først kommet på akutmodtagelsen, og har vi AKS mistanke, skal vi have lav tærskel for EKG og troponin(er), men kan undlade ved særligt lav-risikogrupper.
Har patienten brystsmerter, misser vi ikke særlig mange med OMI ved EKG- og troponinæraen (selv før høj sensitivitetstroponin jf Pope fra 2000!). Udfordringen i fremtiden er derimod at frasortere patienter uden at overdiagnosticere dem. Atypiske symptomer for AKS er der, hvor vi kan blive bedre, og særligt ved højrisiko grupper som graviditet- og fraile ældre. Bemærk, at det er vigtigt i din bedømning af patienten at skelne imellem, om patienten giver dig nogle af oplysningerne spontant eller du specifikt må spørge om dem. Spontant givne oplysninger har generelt en højere værdi.
4. Før vi overvejer AKS: Gestalt og helhedsbedømningen
Gestalt kan siges at være “mønster-genkendelse”, og fejlende ved gestalt relaterer særligt til “unknown unknown”-problemet (ved du, hvordan en AKS – både typisk og atypiskt ser ud?). Gestalt er det vi ubevidst anvender i diagnostikken, når vi ikke bevidst tænker over detaljerne gennemgået herover (som kan kaldes system 2 tankegang).
Før vi overvejer AKS: Der er et step FØR man overvejer om dette kan være AKS – det er, at man sætter sig ned, spørger åbent og lader patienten fortælle om sine symptomer uden afbrydelse. Ud fra klinisk epidimiologisk kendskab, patientens demografi og denne historie og eventuelle specifikke follow-up spørgsmål, må vi danne os vores billede af, om dette overhoved skal overvejes som AKS. I fald det skal, så går man videre med EKG og TnI (eller hvis du er almen praksis læge, sender patienten ind til akutmodtagelsen). Men ikke før. Som Justin Morgenstern skriver
Clinical judgement is enough to rule out ACS for many patients in the emergency department. Just don’t contradict yourself and try to use gestalt to rule out ACS in patients where your gestalt is that ACS is a possibility. That would be silly
Justin Morgenstern, First10Em: Physician Gestalt for ACS
Faktisk siger flere studier, at vores gestalt om AKS er en af de bedste tests overhoved, så den ”klassiske lægekunst” er i høj grad stadig noget vi skal holde fast ved (jf tidligere blogs på akutmedicineren.dk: kommunikation del 1-3 og brick by brick). Vi skal bare passe på det vi kan kalde “dobbeltkonfekt”, som beskrevet i quoten herover. Når vi har mistænkt AKS, kan vi ikke på gestalt udelukke den.
Følgende studier på gestalt bedømming af AKS i akutmodtagelsen er lavet indenfor de senere år (nb: dette er ikke systematisk gennemgået, men en kvalificeret cherry picking)
- Oliver et al, 2019: https://first10em.com/physician-gestalt-for-acs-oliver-2019/ – i HEART score æraen -> udvalgt PICO: multicenter, 18 hospitaler i United Kingdom, klinikere var ikke blindet for troponin / EKG. 1613 patienter, 207 med MI (14,9%), 33 med MACE <30 dage(dvs revaskularisering), sv.t rule in rate på 17%
- Mokthari og Dryver et al, 2015: Diagnostic values of chest pain history, ECG, troponin and clinical gestalt in patients with chest pain and potential acute coronary syndrome assessed in the emergency department -> udvalgt PICO: svensk enkeltcenter akutmodtagelse i Lund, anvender high sensitive troponins. 1151 brystsmertepatienter, 146 (12,7%) AKS – 97 MI (8,4%) 49 UAP .
- Body et al, 2014: Can emergency physicians ‘rule in’ and ‘rule out’ acute myocardial infarction with clinical judgement? – se også St emlyns (https://www.stemlynsblog.org/getting-chest-pain-evaluation-right-umecs16/ ) –> udvalgt PICO: single center, 458 patienter, 81 med AMI (17,7%), ej blindet til EKG, men forsøgt blindet til TnI
Ligner studiepopulationen den population jeg ser?

Dette spørgsmål er et af de vigtigste, når vi skal forsøge at applicere resultater til vores egen kliniske hverdag, fra overstående 3 studier om gestalt.
Og det korte svar, for dig, der arbejder i en dansk akutmodtagelse (særligt udenfor København): Nej!
Oliver et al og Body et al er engelske akutmodtagelser, hvor de inkluderede patienter “mistænkt for AKS”. Dvs den population de studerer allerede er “mistænkt for AKS”, og er således “gestalt positive”. Som Justin Morgensterns kommentar herover viser, så er dette dobbelt-konfekt. Det vi i virkeligheden ønsker, er at vide, hvor mange af dem, der IKKE fik AKS udredning, der havde AKS.
Alle tre studier (Mokthari et al, Oliver et al og Body et al), har desuden den forskel fra danske akutmodtagelser, at de arbejder med “åbne akutmodtagelser”, hvor alle kan komme ind, hvis de ønsker (eller betaler i Sverige). Det vil sige, at populationen som udgangspunkt på svenske og engelske akutmodtagelser er mindre syge fordi vores primær sektor i Danmark er så stærk til sammenligning. De eneste måder vi kan se uvisiterede patienter i Danmark er enten i København (ikke fysisk visiteret, men 1813 visiteret), og de som kommer ind med 112 (alle kan ringe).
Mokthari et al gjort det lidt anderledes end Body og Oliver. De har taget alle der kom med brystsmerter og taget anamnese, EKG og højsensitivitets TnI på dem – så vidt jeg kan se, er der dog ingen blinding for resultatet af TnI og EKG før klinisk undersøgelse blev foretaget.
Kan vi lære noget fra studierne alligevel?
Ingen af studierne kan direkte appliceres til danske forhold (som studier sjældent kan) – jf brick by brick del 2 (akutmedicineren.dk)
De engelske studier har dog lavet et studie, som ligner det system vi arbejder i danske akutmodtagelser – “nogen” har bestemt at denne patient skal til akutmodtagelsen (lidt som når de inkluderer patienter med “mistanke om AKS”). Disse studier fortæller os, at en bred gestalt uden blodprøver (historie, klinisk undersøgelse og EKG), har følgende resultat:
- Body: “definetly not” og “probably not” udskrives – AKS missrate 3,5% – sv.t LR 0,15.
- Oliver: “definetly not” og “probably not” udskrives – AKS missrate 10%
Kombineres alle metoder (EKG, høj sensitiv TnI, Gestalt), fås dog et noget andet resultat
- Body: udskrivelse af “definetly not”, “probably not” og “could be” gestalt-grupperne, efter udredning med EKG og TnI – Sens 100%, Spec 46,6
- Oliver: udskrivelse af “definitly not”, “probably not” – sens 86,2%, Spec 50%
I begge studier fandtes desuden, at mente lægen at diagnosen “definetly”, var AKS efter Gestalt, EKG og initale højsensitive TnI, havde kun 40-60%, på AMI (lidt flere MACE <30 dage – men det er vi mindre interesserede, da den består af revaskularisering – jf senere diskussion i del 4, eller se First10Em Stress test-blog -> “revascularization”). Dette svarer til LR+ på 3,9
Det svenske studie af Mokthari er lidt sværere at fortolke ift danske forhold. Populationen er blandet (henvisningspatienter med “walk in” patienter), og som forvenet har de også en mindre AKS- og MI prævalens end de engelske studier. Vi kan dog anvende nogle dele af studiet
- Gestalt uden EKG og TnI (dog ikke sikkert blindet): I denne population viser det sig, at en historie uden mistanke om AKS (no suspicion) har en LR+ på 0,02.
- Gestalt med TnI og EKG: I denne relative lav-risiko population vil man med første højsensitive TnI og EKG vil man med lav mistanke (low suspicion) og ingen mistanke (no suspicion) på gestalt, kunne få en LR+ på hhv 0,01 og 0,04 (dog misses nogle AKS’er)
Bottom Line om gestalt ud fra overstående studier: Gestalt kan stadig i høj grad anvendes, men skal anvendes i rette population. Særligt ud fra overstående studier, må vi overveje, hvilke populationer der er sammenlignelige med dem vi ser, da dansk akutmedicin er væsentligt anderledes end både engelsk og svensk pga visitationssystemet.
Desuden skal vi uanset kontekst aldrig lave “dobbeltkonfekt” med gestalt – har vi ikke mistanke om AKS, skal vi ikke udrede folk. Har vi mistanke, skal vi. Længere er den ikke. Men vi skal være opmærksomme på, om én læge allerede har bedømt patienten som AKS suspekt, så går det ikke at sænke risikoen for AKS til <2% alene på AKS.
Vi mangler (fortsat) desværre studier på de atypiske præsentationer – det er hér vi misser folk. Den perfekte balance mellem udredning for atypiske præsentationer af AKS uden overudredning, er endnu ikke fundet.
Ud fra de specikke gennemgåede studier er mine konklusioner
Patienten der er lægevisiteret
- Patienter som er læge-visiteret (“gestalt positive” for AKS), skal ikke sendes hjem uden TnI og EKG udredning, samt gestalt bedømning, hvis vi vil have en miss-rate på <2%
- Hos patienten med læge-visiteret gestalt positiv (“obs AKS”): En enkelt TnI er ikke altid nok til at komme under 2% miss-rate grænsen. Der er i studierne ikke beskrevet noget om, hvornår TnI er taget ift debuttid, hvilket er essentielt. TnI skal altid ses i perspektiv til hvornår den er taget, og øvrige kliniske oplysninger. Dette indgår i HEART-scoren og HEART-pathwayen (jf del 4 og Emcases Ep 128: low risk chest pain)
Patienten der ikke er lægevisiteret
- Alle med brystsmerter skal ikke til akutmodtagelsen ud fra overstående studier. Bedømmer du som læge, at risikoen for AKS er lav, så er den det også med stor sandsynlighed. Selvom denne konklusion er indirekte ud fra studiernes formål.
- Patienter som har brystsmerter, men IKKE er blevet vurderet af læge, kan ud fra gestalt bedømmelse stadig undgå at få taget TnI og EKG, hvis du ikke mener det er AKS suspekt – men vi mangler studier på dette område
5. Kombination af begge verdener
Flere jeg har talt med om præ-test sandsynlighed, likelihood ratios og probabilistisk tankegang, har tendens til (forståeligt), at misfortolke det, og tror vi skal frem med lommeregneren ved alle vores patienter. Det er IKKE tilfældet: Var patienterne “pakker”, og ikke mennsker; havde vi fuldt overblik over deres forhistorie; var vi fantastiske til at undgå kognitive- og affektive bias, og var studierne gjort godt på relevante populationer, og vores kommunikations- og undersøgelses evner var i top, så var der måske mulighed for en rent matematisk tilgang til patientenerne. Men dér er vi langt fra, og kommer det nok (heldigvis) aldrig.
Everybody’s experience of illness is their own, and that is where illness becomes distinct from disease. I recall a non-medical friend of mine wondering why it was not possible to define all the characteristics of a single disease. Then a map or a formula could be created for all the common ailments and doctors might even find themselves obsolete – tap your symptoms into a computer program and a diagnosis pops up on a screen. That friend had failed to understand the human condition. A persons’s personality and their life experience molds the clinical presentation, the response and the outcome of any brush with illness […] That is why medicine is an art
Dr Suzanne O’sullivan, It’s all in your head, 2016
Kommunikationen med patienterne er mere end blot diagnostisk, den bl.a. også terapeutisk og alliance-skabende.
Der er dog nogle meget klare “pearls” man kan lære til gavn for patienterne, ved at kende til den probabilistiske tankegang, som jeg har skrevet dybdegående om i tidligere blogs bl.a. brick by brick, og blogs om probabilistisk tankegang, samt 101-opsamlings bloggen.
Sammenhængen mellem gestalt (som nok må siges at være system 1-lignende) og analytisk tankgegang (system 2; LR-bedømmelse, Præ-test sandsynlighed-bedømmelse etc), er vigtig i al lægevidenskab (og i liv i det hele taget). Dette er sagt godt i et meget læsværdigt paper på gestalt i akutmodtagelsen af Cervellin et al, 2014
What clearly emerges in this brief discussion [om gestalt] is that physicians should perform at their best both in Gestalt and analytic approaches, tightly combining both components of clinical judgement
Cervellin et al, 2014: Do clinicians decide relying primarily on Bayesians principles or on Gestalt perception? Some pearls and pitfalls of Gestalt perception in medicine
Det er ikke enten-eller. Det er både-og
Bottom line: Alle tests (gestalt, anamnese, objektive fund, paraklinik) skal forstås i deres kontekst. Vi kan aldrig vurdere nogen test, uden en vurdering af præ-test sandsynligheden. Præ-test sandsynligheden for brystsmertepatientens diverse differentialdiagnoser starter med kendskab til din popiulation og at overveje om dette overhoved lyder som hhv AKS, LE eller aortadissektion (gestalt).
Har vi først mistænkt AKS, så er der ingen enkelt symptomer eller tegn der nævnværdigt ændrer ved sandsynligheden, men kombinationen af disse med gestalt, og viden om demografi (og epidemiologi i din population), samt EKG og TnI vil kunne få patienten under en acceptabel miss-rate som oftest sættes til 2% (jf del 2-5)
Det er sjældent bedømmelsen af brystsmertepatienten der fejler ved gestaltbedømmelse – det er de atypiske præsentationer for AKS der gør det. Vi må altså udvide vores gestalt: Særlige faldgrupper er atypiske præsentationer ved patienter der normalt præsenterer atypisk fx fraile ældre eller gravide kvinder.
Overdiagnostik af atypiske AKS præsentationer; problemet med somatisering af patienten med smerter og evt funktionelle tilstande og tolerering af vores egen usikkerhed, diskussion i Danmark om en “acceptabel miss rate” samt kommunikation af risiko til patienten, er de fremtidige emner, der efter min mening er fremtidige fokusområder indenfor patienten med brystsmerter, og patienten med mistanke om AKS.