UPDATE 21/12-21
Jeg har nu lavet en lang engelsksproget videoforelæsningsserie med eksempler, som en grundig gennemgang for akutmedicineren til akut neurologisk tankegang (del 1 > del 2 – i del 2 går jeg mere ind i non-technical skills):
Desuden findes en anden video om hovedpine, kommunikation og compassionate care som er særlig vigtig ved mange patienter med neurologiske præsentationssymptomer
ORIGINALE POST fra 2019:
Bøger om den neurologiske metode (også for akutmedicinere)
- Daniel Kondziella et al, 2017: neurology at the bedside (kapitel 1-3)
- Aaron Berkowitz, 2017: Clinical Neurology and neuroanatomy – a localization based approach
- Suzanne O’sullivan, 2016: It’s all in your head
- Geraint Fuller, 2019: Neurological Examination Made Easy 6th edition, 2019
- Artikler af Jonathan Edlow (akutmediciner ved Harvard med subinteresse i neurologi)
Behøver du en 6 minutters brush up på 80% af den akutmedicinske relevante neuroanatomi
Kilder om den probabilistiske metode (også for neurologer og alle andre læger!) – HØJT ANBEFALET LÆSNING!
- Jonathan Howard, 2019: Cognitive Errors (generel casebaseret bog om system 1 og 2, lavet af neurolog og psykiater med neurologiske eksempler)
- Schechter et al, 1985: Diagnostic testing revisited: pathways through uncertainty
- Gallagher et al, 1997: Clnical utility of likelihood ratios
- EmCases podcast: Ep 11 (Cognitive Decision Making and Medical Error), Ep 47 (EBM), 62 (Diagnostic decision making in the ED), Ep 75 (Decision Making in EM – Cognitive Debiasing, Situational Awareness & Preferred Error) + 49 og 51 (kommunikation i akutmodtagelsen) + 129 (overcrowding)
- First10Em: Cognitive errors
- Croskerry et al, 2012: Cognitive debiasing part 1+2
- BroomeDocs podcast / slideshow: Bayes – a diagnostic oddesy
- Carley et al, 2017: Risk, probability and decision making in the ED (gratis e-bog)
- Carley, St emlyns – Making good decisions (st emlyns blog)
- Carley, St emlyns – do risk factors factor in the ED? (video)
- Simpkin, 2016: Tolerating Uncertainty — The Next Medical Revolution?
- Cervellin, 2014: Do clinicians decide relying primarily on Bayesians principles or on Gestalt perception? Some pearls and pitfalls of Gestalt perception in medicine
Andre højt anbefalede kilder (for alle læger interesseret i emnet)
Når du skal forstå neurologi, må du forstå, hvornår det IKKE er det:
- Suzanne O’sullivan, 2016: It’s all in your head
- Stone og Hallet, 2018 – Handbook of clinical neurology vol 139 (det funktionelle neurologiske syndrom)
- Andersson et al, 2019: Functional (Psychogenic) Neurological Disorders: Assessment and Acute Management in the Emergency Department
- Topcuoglu et al, 2018: Recrudescence of Deficits After Stroke Clinical and Imaging Phenotype, Triggers, and Risk Factors (post-stroke recrudescence)
- Hansen et al, 2018: Funktionelle symptomer inden for neurologien og den positive diagnostiske proces (ugeskriftet)
- DSAM 2013: funktionelle tilstande
- SST 2018: funktionelle tilstande
For gennemgang af faldgrupper ved neurologisk undersøgelse, anbefales
- Dubosh og Edlow et al, 2015: Types of diagnostic errors in neurological emergencies in the emergency department
- Jonathan Howard, 2019: Cognitive Errors (generel casebaseret bog om system 1 og 2, lavet af neurolog og psykiater med neurologiske eksempler)
Andre gode artikler / kilder at kende til indenfor akut neurologi
- Do et al, 2018: Red and orange flags for secondary headaches in clinical practice: SNNOOP10 list
- Stuart Swadron, 2009: Pitfalls in the Management of Headache in the Emergency Department
- ILAE (international league against epilepsia)
- Neuro NBV
- Neurous.dk
- Youtube: Inducing syncope: the fainting lark
- Orr et al, 2015: Emergency Headache
- Ganti et al, 2018: Neurological Emergencies (how to do a fast focused evaluation)
Disclaimer: Jeg er ikke neurolog, men har arbejdet forskellige steder i Danmark og Sverige indenfor akutmodtagelse-, ambulant-, og afdelingsneurologi (børn og voksne), psykiatri- og gerontopsykiatri, samlet set ca 2,5 år. Mit ønske i denne blog er ikke at opfinde den dybe tallerken indenfor neurologi, men i stedet præsentere neurologi i akutmodtagelsen som noget overkommeligt og noget vi alle skal lære og kunne håndtere (om ikke andet, for at kunne konferere med neurologerne). Jeg ønsker derimod noget, som jeg ikke har set eksplicit beskrevet før i danske lærerbøger: at parre probabilistisk tankegang med neurologien
Udfordringen ved bedømmelsen af den neurologiske patient
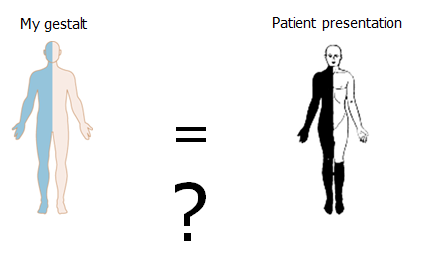
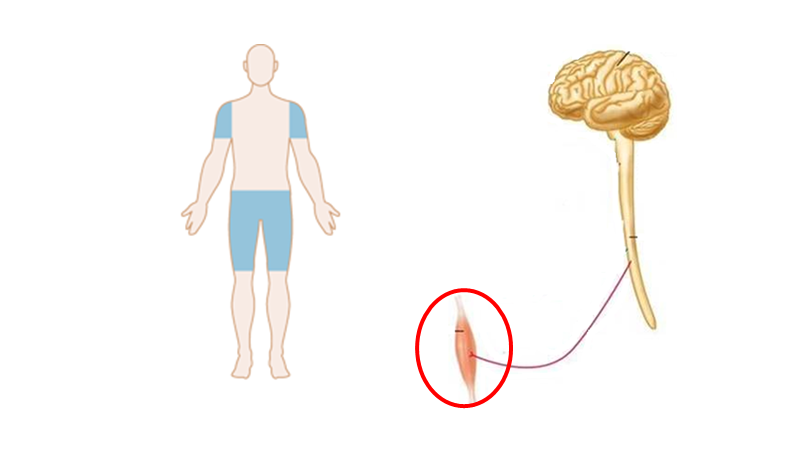
Case: Din 39 årige kvindlige patient, præsenterer med overstående symptomdistribution (hø). På triage-skærmen står der “følelsesforstyrrelser”. Hvordan kommer vi nærmere, om dette er en skade på nervesystemet?
Dette afhænger, som du vil se, stort set bare af anamnestiske- og objektive fund. Derfor er neurologi et meget klinisk speciale, som afhænger af mønstergenkendelse (gestalt).
Min gestalt (ve) Vs det patienten præsenterer med (hø)
Neurologi er langt henad vejen mønstergenkendelse (gestalt). Når vi bedømmer patienten indenfor neurologi (og anden akutmedicin), spørger vi os selv: Findes der et syndrom (indenfor mine illness scripts eller lægevidenskabens illness scripts), der har samme distribution af læsioner som patienten beskriver? (jf manden til venstre). Da der sjældent findes paraklinik, der kan hjælpe os i akut neurologi (og fordi paraklinikken skal bedømmes ud fra præ-testsandsynligheden), er der to logiske muligheder, hvis der er stor diskrepans mellem “vores gestalt” og patientens præsentation:
- Er min gestalt god nok? (tvivlens sorte hul) – findes der måske et syndrom som ser ud som patienten siger, som jeg bare ikke kender (known unknowns)
- Er patientens symptomer Psyko-somatik? alle symptomer kan skabes af hjernen (smerte, neuorologiske udfald etc) (jf Susanne O’sullivan, Andersson og Stone/Hallet herover)
Tvivlens sorte hul kan være stort indenfor neurologi, og jeg tror det er derfor mange er ukomfortable med disse patienter. Vi må på den ene side altid være ydmyge overfor vores evt manglende viden (known unknowns – og spørge en neurolog til råds), og ydmyge overfor unknown unknowns (ting vi ikke overvejer, at vi ikke ved – og laver premature closure på), men kan på den anden side heller ikke MR skanne alle med diffuse følelsesforstyrrelser.
Som alt andet i akutmedicin bliver den neurologiske bedømning altså en probabilistisk bedømning. Og ja, du vil alt efter hvilken neurolog du spørger få forskellige svar – men hvis neurologen kender til probabilistisk tankegang, kan man spørge dem, hvor mange de har lyst til at indlægge af denne slags patienter, for at finde én af den slags sjældne diagnoser de foreslår?
Neurologerne…

Ikke et ondt ord om neurologer (eller nogen andre specialer for den sags skyld). Flere af mine gode venner (håber jeg også efter dette blog indlæg) er neurologer. Desuden har jeg i en stor del af min lægekarriere arbejdet sammen med dem, og jeg har stor respekt for deres virke og kunstskab. En del af mig betragter mig endda som en af dem, og uden dem, og deres viden, ville jeg aldrig kunne skrive denne blog – endsige være den læge, jeg er i dag (Af hjertet TAK til Christina K., Christian S., Christian P., Faisal, Don Mette, Nina S., Gyde D., Marie-Louise L. og Alexander C., Arkadiusz, Jesper E., Jan M., Ulrika L. og alle andre på neurologiske / psykiatriske afdelinger, jeg har arbejdet med)
Dog synes jeg, at der (også) i neurologi-kulturen findes en tendens til base rate neglect, hvor der (efter min erfaring og mening – igen dette er ikke lig med fakta) oftere end man burde, udredes for årsager, som er ekstremt sjældne (number needed to scan eller LP er ganske højt). Base-rate neglect er en kognitiv bias, der kort sagt betyder, at du har tendens til at se heste som zebraer, fordi du ikke tager højde for tilstandens sandsynlighed i baggrundsbefolkningen – sagt på en anden måde: at se en positiv test som diagnosegivende uden at tage højde for præ-testsandsynligheden (af samme grund, når du ringer til højspecialiserede centre som Rigshospitalet for råd, kan konulten finde på tilstande at udrede for, som du aldrig har hørt om – fordi deres “base rate” på neurologisk afdeling RH er betydeligt anderledes end din base-rate på akutmodtagelsen i Esbjerg)
Neurokirurgern, Henry Marsh beskriver i Do No Harm, om sine kolleger, neurologerne: “These illnesses like multiple sclerosis or parkinsons disease or strange and obscure diseases, sometimes untreatable, which neurologists find deeply fascinating, and which they collect like rare butterflies and report in their journals”.
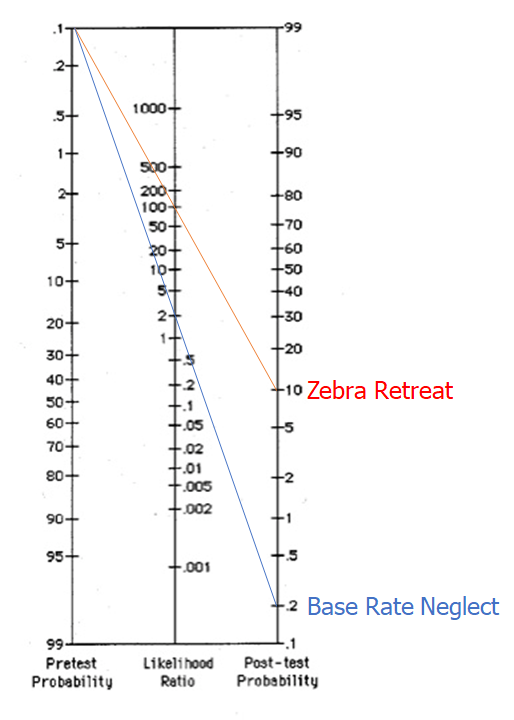
I patienten, der begås base-rate neglect på, har man efter en positiv test der er dårlig (LR+ på 2), gået ud fra, at patienten har diagnosen
I patienten med zebra retreat, er der tydelige tegn på at denne sjældne tilstand skal overvejes og testes videre for, da post-test sandsynligheden er 10% (det betyder stadig ikke, at det er diagnostisk, men nok til at man skal kigge videre på det)
Billedekilde: egen produktion
Til neurologernes forsvar, så er summen af alle sjældne sygdomme indenfor neurologien formentlig relativt høj, selvom den enkelte diagnose er ekstrem sjælden. Hvis vi tænker på “the threshold model” (jf fx Dryver et al: beslutfattande på akuten eller akutmedicineren: probabilistisk tankegang del 1-4), og STEPS, så er mange af neurologernes diagnoser ekstremt alvorlige, hvilket gør, at tærsklen for undersøgelse går betydeligt ned. Det modsatte af base-rate neglect er “zebra reatreat” – hvor en sjælden tilstand ikke overvejes bare fordi den er sjælden, selv ikke ved meget typiske symptomer (tænk fx din brystsmertepatient med hoste og wheezing fra Afrika med kendt sickle cell anæmi, hvor du ikke overvejer acute chest syndrome fordi den er “sjælden” i almen befolkningen)
Yderligere til deres forsvar, skal de ofte træffe beslutninger ud fra sekundær-oplysninger – en undersøgelse og primær bedømning lavet af dig (hvad er din inter rater reliability? hvad er din LR?). Da måden hvorpå vi optager anamnesen og objektiv undersøgelsen i neurologi, er vigtig for bedømningen, kan man forstå, hvorfor man ofte, når man bliver spurgt som konsult-neurolog, vil være på “den sikre side”, og laver en eller anden form for udredning.
På den anden side
- Når lav-risiko grupper præsenterer med uspecifikke symptomer, må man efter grundig vurdering gerne anvende “time as a test” og orchams razor, for at undvige overdiagnostik og risiko for falsk-positive og de komplikationer der OGSÅ følger med dette (Brodersen, 2018: Overdiagnosis: what it is and what it isn’t). Hvor lav skal din risiko være, før du vil slippe patienten hjem?
- Funktionelle symptomer er meget hyppige indenfor neurologien (10-30% alt efter studie og setting), og heldigvis er man begyndt at blive mere opmærksomme på dem (jf herover Suzanne O’sullivan: it’s all in your head; Andersson et al, Stone og Hallet et al). Overdiagnostik af denne gruppe kan forværre deres symptomer og prognose, og derfor – jeg anbefaler alle læger uanset speciale, at sætte sig ind i disse patienter, og den litteratur som jeg har præsenterer herover (uanset deres præsentationsmetode: smerte, neurologiske udfald eller træthed)
Jeg håber du via denne blog kan få indsigt, og skærpe din neurologiske bedømning, så vores samarbejde med neurologerne kan blive endnu bedre og med større forståelse for hinandens ekspertiser og bedømninger. Kram din neurolog næste gang du ser ham/hende – I er på samme hold!
De svære patienter
De sværeste patienter at se i akut neurologi, er efter min mening IKKE de tydelige strokes, blødninger eller status epileptikus (ingen er som regel i tvivl hér). Det er sandsynlighedsvurderingen af lav-moderat risiko patienter, hvor vi ud fra et test-threshold er lige på kanten. Mit bedste bud hér er, at anamnese og objektiv undersøgelse er dit bedst værktøj (som altid).
Dette er perfekt eksemplificeret ved “TIA” (“hjernens ustabile angina pectoris”). Ingen paraklinisk test kan diagnosticere en TIA (der er ifølge tids-definitionen, ingen test udover anamnesen, risikovurderingen og tid, der giver diagnosen TIA) – derfor er det bare ud fra din kliniske vurdering (evt vha neurolog), at beslutningen om indlægning og behandling med ASA livslangt skal træffes. Dette er måske lettere på den 80 årige med overgående svaghed i højre side, dog noget sværere ved den 50 årige med kardiovaskulære risikofaktorer, angst-tilstand og overgående følelsesforstyrrelser i ene hånd.
Det der er særligt interessant ved disse lavrisiko-patienter er følgende: Hvem ser disse patienter? ALLE læger! (da de tydelige som regel køres direkte til neurologerne). Derfor må vi alle være i stand til at håndtere dem.
Men hvad med paraklinikken? Den spiller vel en rolle
Ja, paraklinikken spiller en rolle. Men den er ikke så stærk, som den er i andre akutmedicinske områder. Jeg plejer at sige, at
“Der findes ingen troponin i neurologi”
Det er sjældent blodprøver giver anden mening end i differentialdiagnostisk øjemed i neurologisk akutmedicin. Lumbalpunktion kan laves på særlige indikationer, men medmindre du stikker efter xantochromi (SAH) eller infektionstal (neuroinfektion), er det heller ikke en test du anvender ofte.
Og inden du nævner CT skanningen, så husk følgende ved CT skanninger:
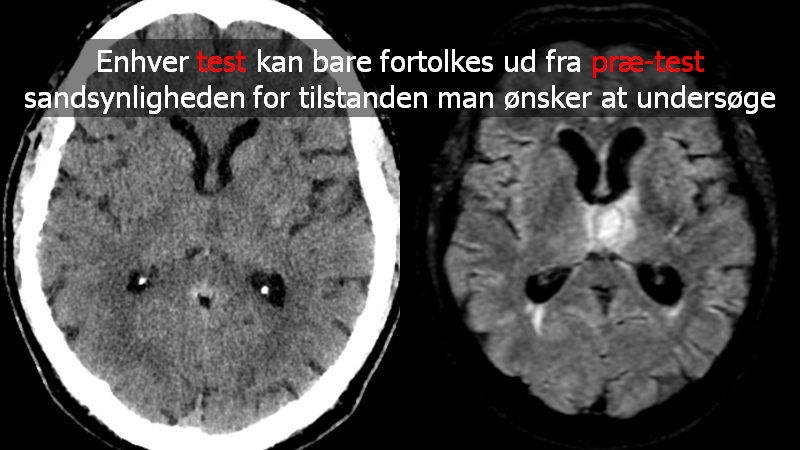
Billedet til venstre viser en patientcase: 80 årig mand med ny hovedpine og feber. CT lavet inden LP, mhp tryk. Beskrevet normal (ud fra de oplysninger radiologen fik). MR skanning til højre dage efter med abscess. I retrospekt kan man ane området (men radiologen var ikke primet for at finde det)
om en test er “normal” afhænger af prætest sandsynligheden
Billedekilde: egen case
- Afhænger af fortolkeren: om en test (skanning) er normal, kan BARE fortolkes ud fra præ-test sandsynligheden (jf blogindlæg: Brick by brick, og e-bogen). Derfor er det monumentalt vigtigt, at du giver din radiolog nok data til at danne sig en god præ-test sandsynlighed i henvisningen, og spørger om de rigtige ting. Radiologer er ikke bare robotter, der objektivt kan se alle tegn – det vil svare til, at du tager alt det EKG-maskinen skriver på EKG’et for gode varer. Radiologer fortolker og vægter deres tid ud fra præ-test sandsynligheden og spørgsmålet der stilles.
- Afhænger af fortolkerens erfaring: Som alle tests har CT’en en IRR (interrater reliability). Med overstående in mente, så er nogle vagthavende radiologer mere vant til at kigge på skanninger af hovedet og nervesystemet end andre (ligesom du måske er bedre til EKG fortolkning end a-gas analyse). Dette har betydelse, eftersom nogle studier (Perry et al, 2016), går ud fra en hvis erfaring for den radiolog der beskriver, før at du kan svare på spørgsmålet: er min patient inkluderbar i dette studie (og kan jeg derfor anvende studiet). Hvis du fx ikke har en neuroradiolog eller en erfaren radiolog i vagt og du har en SAH mistanke på en hovedpine indenfor 6 timer: CT’en er aldrig ubrugelig. Men den LR som findes i studiet, skal måske justeres (= ned. Fordi en mindre erfaren radiolog må betragtes som en dårligere test) – og så må du ud fra din præ-test sandssynlighedvurdering, overveje, om risikoen reduceres nok. Bemærk det er altså ikke dikotomt – kan enten anvende studiet eller ej (din radiolog har jo set CT af hovedet før!). Det er spektrum-baseret. Det er virkeligheden og virkelig akutmedicin.
- Er ikke en “rule out” test i de fleste tilfælde: alle tests har særlig LR+/-, for særlige diagnoser. I faldende rækkefølge, har CT skanningen en høj LR: traumatiske blødninger (kSDH, EDH) > spontane blødninger (ICH, SAH) > alt andet. Tænk over, hvad du forsøger at udelukke inden du bestiller – og overvej om det er muligt, eller det blot bliver en reduktion i risiko (hvilket dog også kan være acceptabelt i mange tilfælde, med grundig information af patienten)
- CT skannings accuracy kan forbedres med kontrast…men: CT angiografi (storkars stroke med EVT mulighed, Hypoperfusionsstroke, Cervikal Dissektion, RCVS), CT venografi (Sinus Vene trombose), CT kontrast (hjernetumor), Perfusions CT (penumbra vurdering af stroke patienten). Her skal vi dog tilbage til EBM (EmCases Ep 47 podcast) – specifikt den del af triaden der hedder “clinical circumstances”. Nogle hospitaler har i dag MR skanninger til rådighed i akutmodtagelsen. Nogle har angiografi. Jeg har oftest arbejdet på steder uden MR eller angiografi mulighed (eller i hvert fald kun x1 pr dag efter samtale med bagvagt i forskelige specialer). Argumentet er ofte, at de diagnoser man overvejer, sjældent behøver angiografi i dag, da man oftest kan behandle alligevel, og lave skanningen i morgen.
Er du på et center der har alle tests til rådighed, så husk stadig på følgende perle fra EmCases Ep 129: ED overcrowding and access block

Derfor er det også sådan, at majoriteten af diagnostik i akutmodtagelse-neurologi kan (og skal) gøres ud fra klinik alene om nødvendigt!
Husk også, regel nr 1 i probabilistisk tankegang: en test kan kun bedømmes ud fra præ-test sandsynlighedsbedømning.
Så DWI/ADC læsionen på din MR, er ikke nødvendigvis sandt-positiv. Men du er nok nødt til at udrede patienten og måske lave en ny, hvis symptomerne er væk igen.
Et ord om “neurologiske præsentationer” og bias
Alle “neurologiske præsentationer” har ikke nødvendigvis en neurologisk primær årsag. Fx
- Svimmelhed: majoriteten er medicinsk årsag (kardiel, polyfarmaci, dehydratio, elektrolytter etc) – har de dog nystagmus, er der pludseligt højere sandsynlighed for otoneurologisk tilstand (edlow, 2018: A NEW DIAGNOSTIC APPROACH TO THE ADULT PATIENT WITH ACUTE DIZZINESS)
- Svaghed / stroke-lignende præsentationer: pas på mimicks (fx post-stroke recrudescence, uthoffs fænomen) og medicinske årsager (fx er en “atypisk” men relativt hyppig præsentation af aortadissektion, neurologiske udfald! – evt uden smerte!) (EmCases Ep 92: Aortic dissection og Gaul et al, 2009: Neurological symptoms in aortic dissection – a challenge for neurologists). Et andet eksempel er myopati-symptomer pga hypoK+ eller statinbrug.
- Hovedpine: Som alle smerter – smerte-syndromet / bio-psyko-social modellen og ekstrakranielle / metabole problemer
- Krampe-lignende anfald: fx post-synkopale myoklonier (se fx youtube videoen – “Inducing syncope: the fainting lark”) og PNES (se Stone og Hallet et al herover)
Pas derfor på
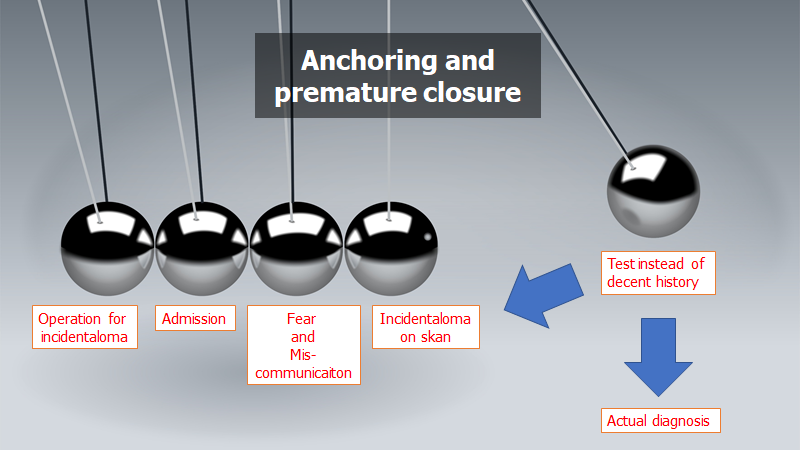
- Anchoring / premature closure: Tænk i sandsynligheder (hvor meget skulle du tænke, at sandsynligheden er for at anfaldet er epilepsi Vs synkope? – hvorfor og hvilke tegn/symptomer, får dig til at sige det ene Vs det andet? Hvilken grad af post-test sandsynlighed er du tryg med at sende patienten hjem med?)
- Diagnostic momentum og framing (undgå at låse / anchor din tankegang ved at kalde en patients anfald for epileptisk. Beskriv i stedet det som TLOC eller blot “et anfald” med mistanke om epileptisk årsag pga fx tungebid, fæcesafgang)
Tving dig derfor også gerne: kan det hér være en medicinsk årsag før du går i den åbenlyse neurologiske årsagstankegang (forcing strategy)
The nature of the complaint: Make sure you have understood what the patient is describing. […]. When a patient says his vision is blurred, he may mean it is double. A patient with weakness but no altered sensation may refer to his limb as numb.
Geraint fuller, 2019: Neurlogical exam made easy, 6th edition
Den neurologiske metode
Det tog mig lidt tid, men jeg kan nu se, at den neurologiske metode bygger på probabilistisk tankegang. Metoden er beskrevet i Berkowitz (herover) og Kondziella (herover), og er også den metode jeg anvender.
When examining a new patient, the first question a neurologist attempts to answer is, “Where is the lesion?” The main principle is to use the history to generate an anatomical hypothesis and to use the bedside examinationto confirm this hypothesis . Following this, other features of the history, such as epidemiological data and the speed of symptom development, are taken into account in order to answer the next question, “What is the lesion?” Thereafter, the neurologist forms a differential diagnosis and a working diagnosis and then accordingly orders the most relevant laboratory tests. Strictly adhering to this schema allows for a safe and rapid diagnostic procedure. Obviously, in many cases, the experienced neurologist uses a shortcut called instant pattern recognition to reach a diagnosis [red: gestalt]. Yet, when confronted with a difficult diagnostic problem, nothing is more useful than to return to the bedside and take a more detailed history.
Kondziella et al, 2017: Neurology at the bedside 2. edition
Når du ser patienten og tager anamnese, starter du med et åbent spørgsmål (for at skabe alliance, og for ikke at misse detaljer, som ville blive udeladt ved at starte med specifikke spørgsmål – af samme grund tier du stille indtil patienten har fortalt sin historie færdig, og lytter aktivt) – det virker måske som en unødig detalje, men jeg lover dig, at dette er en af de vigtigste ting, jeg kan lære dig indenfor diagnostik.
I hovedet tænker man på to ting når patienten fortæller, og forsøger at danne en gestalt hypotese
- A: Position og associerede symptomer (OPQRST+) – også kaldet “where is the lesion”
- B: Onset, Quality, Timing (OPQRST+) – også kaldet “what is the lesion”
Med dette går man imod sin kliniske undersøgelse, som består af
- Neurologisk Screening (hvis præ-test sandsynlighed er høj nok)
Samt
- Evt Specifikke Neurologiske test (tænk på det som blodprøver – hvis screeningen viser noget, kan man gå videre)
Det er vigtigt, at forstå, at probabilistisk tankegang er med hele vejen hér. Så tag dit fagans nomogram ud

Og vær klar til gennemgangen af metoden – step by step
Anamnesen
[…] the history is more likely to lead to the correct diagnosis than the physical examination. Therefore, as a rule, more time should be devoted to the history compared to the bedside examination […]Although it is of preeminent importance not to push the patient into reporting the symptoms that one is trying to elicit, the history must be meticulous and detailed. A useful clinical rule is that after finishing the history one should have a clear and detailed idea of what has happened and be able to fully visualize the sequence of events.
Kondziella et al, 2017: Neurology at the beside 2. edition
Jeg har sagt det før, men kræver gentagelse:
Din anamnese er en test, og måden du tager din anamnese på afgør hvor god testen er
Mig, 2018 – fra bogen “ting der skal stå tatoveret i nakken på akutmedicineren”, vol 1, kapitel 1
Dette ikke minds i neurologi, hvor der er få / ingen parakliniske test i akutmodtagelsen, der hjælper din diagnostik.
Derfor er dine diagnostiske kommunikationsevner afgørende for om du får den information du behøver. Tiden på akutmodtagelsen kan være bedre givet ud ved at få ordentlig anamnese, og undersøgelse, end at bestille tests, som kompensation for “manglende tid”:
Technology is erroneously considered asubstitute for time
Bernard Lown, Kardiolog og opfinder af defibrilatoren (fra Cervellin et al, 2014: Do clinicians decide relying primarily on Bayesians principles or on Gestalt perception? Some pearls and pitfalls of Gestalt perception in medicine)
Jeg vil derfor anbefale (hvis patienten er stabil), at man starter med ét åbent og bredt spørgsmål som ikke putter ord i munden på patienten. Når patienten svarer, vær da aktivt lyttende (dvs “zip” = ti stille, men vær til stede i samtalen. Det betyder at du stiller spørgsmål ved uklarheder i deres historie, men minimalt, for ikke at afbryde dem) i hele patientens svar, indtil det bliver din tur igen – herefter kan du stille mere specifikke opklarende spørgsmål (ud fra din differentialdiagnose liste)

Beskriver patienten i sine åbne spørgsmål at hovedpinen kom som et slag i hovedet med maximering af smerte indenfor sekunder og var den værste nogensinde, er det helt anderledes, end hvis du spørger specifikt fra start: Har du hovedpine (antager, at “hovedpine”, er patientens præsentationsklage)? Kom den hurtigt eller langsomt? (dikotomt og specifikt spørgsmål – patienten har ingen mulighed for at svare nuanceret. Svaret vil på en akutmodtagelse ofte blive “ja”, bare pga lidelse (Body et al, 2012: Optimising well-being: is it the pain or the hurt that matters? og Graham 2019: ‘They do not care how much you know until they know how much you care’: a qualitative metasynthesis of patient experience in the emergency department, samt Coster, 2017: Why Do People Choose Emergency and Urgent Care Services? A Rapid Review Utilizing a Systematic Literature Search and Narrative Synthesis)
Remember that a spontaneously reported symptom is much more significant than one obtained on direct questioning. For example, patients rarely volunteer that their headaches get worse on coughing or sneezing, and when they do it suggests raised intracranial pressure. In contrast, many patients with tension-type headaches and migraine will say their headaches get worse in these situations if directly asked about them
If uninterrupted, patients usually only talk for 1–2 minutes before stopping. Listen first, then clarify what you do not understand later.
Geraint Fuller, 2019: Neurological Exam Made Easy, 6th edition
Du kan med andre ord via din kommunikation (eller snarere mangel på samme) lede patienten ned i et spor af CT og LP. Udover at udsætte patienten for mulig unødig (omend mindre) skade i form af smerte og stråling, vil dette også skabe anchoring og framing (måske var det ikke “hovedpine” patienten egentlig kom med, men indt i øret? radierende halssmerter fra thorax?)
Fra anamnesen skal vi altid have indsamlet følgende information (hvis patienten ikke specifikt siger noget om det, må vi supplere med specifikke spørgsmål – at patienten måske ikke specifikt siger noget om det, siger også noget i sig selv!):
Punkt 1: Onset, timing og quality
Onset
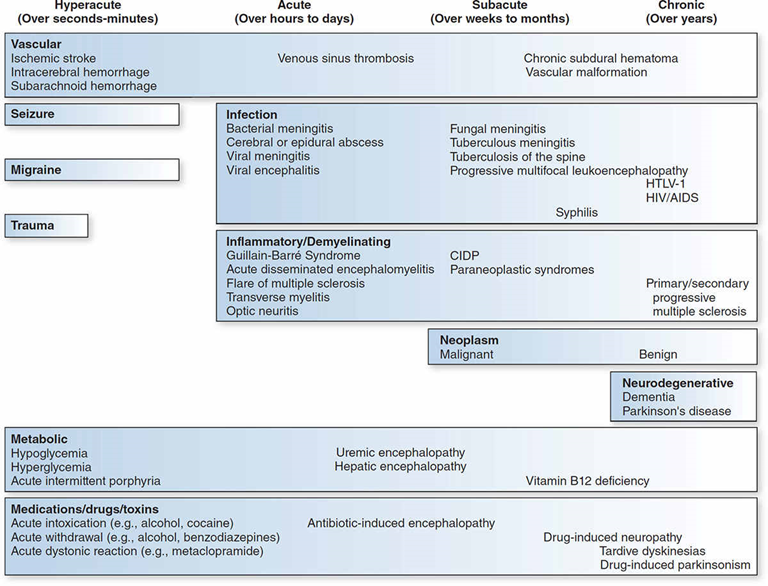
Hvor hurtigt kom symptomerne? (igen spørg først åbent, og lad dem spontant svare, hvis de kan – hvis de ikke kan, ligger der også et svar i det!. Din hovedpine patient med mistanke om SAH, som ikke husker hvornår hovedpinen startede, eller er usikker på, hvor hurtigt den udviklede sig, er i min bog noget lavere sandsynlighed). Som udgangspunkt kommer
- Vaskulære og Epilepsi årsag: sekunder (fleste EP anfald stopper indenfor 2-3 minutter) – bemærk: kan også være “pludseligt opdaget”, særligt ved synssymptomer og følelsesforstyrrelser
- Migræne aura: sekunder til minutter (max 60 min for klassisk aura pr aura symptom)
- Jf i øvrigt tabellen herover
Timing
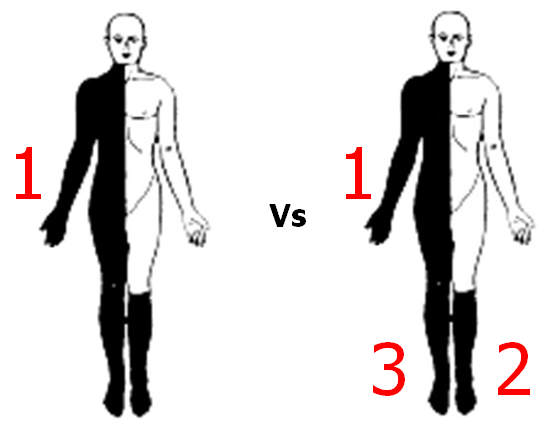
Billedekilde: Egen produktion af billeder fra Hallet og Stone et al
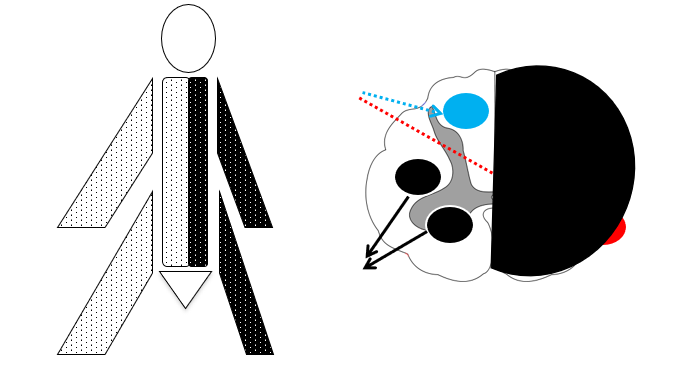
Kommer symptomer successivt (til højre: først arm, sidenhen ben, sidenhen andet ben) eller kommer alle symptomer på én gang (til venstre).
- På én gang: højere sandsynlighed for vaskulær årsag eller generaliseret EP
- Successivt og/eller vandrende: mindre sandsynlighed for vaskulær årsag (oftere migræne aura, fokal EP og jacksonian march, eller dissociativt)
Quality (kvalitet af symptomer)
Hvordan beskrives symptomerne? Generelt kan dette opdeles i “positive” (tilkomst af noget) eller “negative” (fradrag af noget), symptomer.

- Positiv symptomer (noget ekstra): fx migræne aura med zig/zag eller farver (til venstre), smerte / allodyni eller stikninger / “pins and needles” følelsesforstyrrelse, hemibalisme
- Negativ symptomer (noget fratrukket): fx svaghed, følelsesløshed eller synstab i dele- eller hele synsfeltet
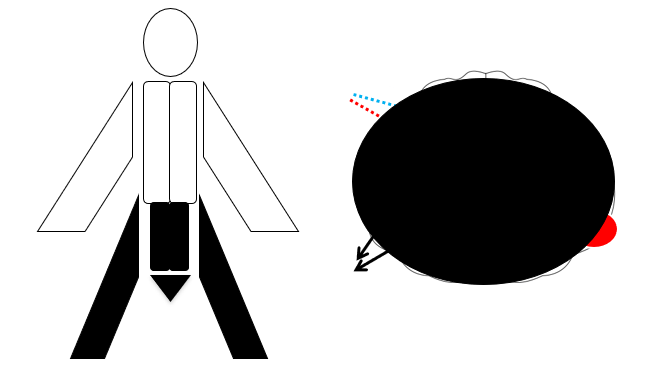
Så samlet set, vil følgende tale mere for non-vaskulær (stroke) årsag:
- Positive symptomer
- Successivt / vandrende symptomer
- Non-akut onset
Hvilket ofte er det vi ønsker at udelukke.Dette er ikke ensbetydende med, at patienter med overstående symptomer aldrig har stroke (jf også slutningen af denne blog – putting it all together): Et ikke helt sjældent eksempel, er de thalamiske infarkter, der ofte præsenterer med: smerter (positiv symptomer), vandrende symptomer (først hånd, så arm) og patienter beskriver derfor heller ikke altid akut debut. Et andet eksempel på undtagelse, er “hemibalisme”, som kan være et stroke-symptom som er positivt. Det er altså et spørgsmål om sandsynlighedsreduktion ved anamnese, og de fleste (særligt unge) patienter med overstående vil have en betydeligt reduceret præ-test sandsynlighed for stroke og anden alvorlig intrakraniel lidelse.
Punkt 2: Position (aka: where is the lesion)
Dette får mange til at gyse fordi man husker de tunge neuroanatomi bøger. Jeg mener dog, at størstedelen af neuro-anatomien kan huskes ved at kende til nogle få mønstre (gestalt).
Although the anatomy of the nervous system is highly complex, distinct anatomical entities have characteristic features
Kondziella et al, 2017: Neurology at the bedside, 2. edition
Husker du ikke andet, så husk følgende billeder for en overgribende “gestalt”:
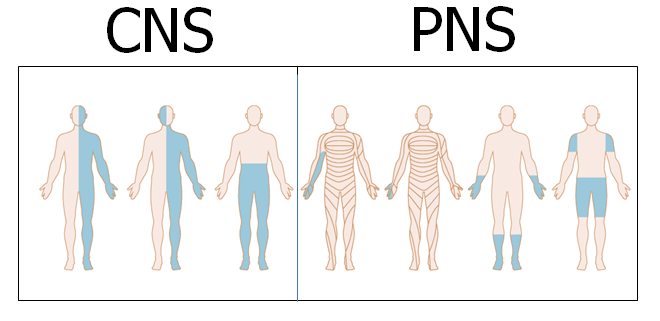
BEMÆRK, at “where is the lesion” (positionen), IKKE siger noget om, “what is the lesion” (årsagen – hvad har skabt læsionen) – altså om der er tale om fx vaskulær årsag eller tumorødem (dette er herover, og paraklinik)
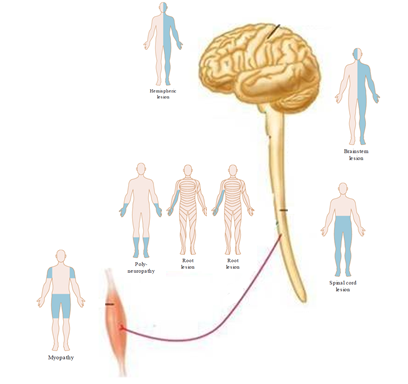
Man kan i Daniel Kondziellas et al’s fantastiske bog finde dybdegående forklaringer ud fra hver af gestalterne (“mændende”) herover. Jeg vil anbefale enhvér læge, der ser patienter med symptomer man mistænker som værende neurologiske, at spørge sig selv INDEN man ser patienten (forcing strategy): Hvor kan læsionen være på overstående figur – og hvordan skal jeg nu teste, for at udelukke at det er CNS eller PNS.
CASE: Et eksempel, kan være en 49 årig mand, der præsenterer med dropfod.
Når vi bygger vores differentialdiagnostik over hhv tidskritiske (og hyppige) og sandsynlige tentative diagnoser, må vi både overveje medicinske/kirurgiske og neurologiske årsager :
- Medicinske / kirurgiske (tidskritiske: få, men evt septisk arthrit, akut iskæmi i benet, aorta dissektion, compartmentsyndrom; Hyppige: DVT, Achillesseneruptur)
- Neurologiske (Tidskritiske: Høj perifær læsion fx L5 = cauda equina eller rod-prolaps / tryk med motoriske udfald, Homunclus stroke for “fodens” motoriske repræsentation, GBS, Hyppige: Peroneus parese)
Vi kan ud fra overstående liste målrette vores somatiske og neurologiske undersøgelse.
- Medicinske: Vi kan hurtigt rule out de medicinske diagnoser evt alene ud fra præ-test sandsynligheds data om MAPLES (baggrundsinformation) og beskrivelses af symptomer. I fald dette ikke er muligt, kan ben-iskæmi udredes med ABI, og DVT, compartmentsyndrom og achilles-seneruptur med hhv Wells score og lokale fund som Thompsons test
- Neurologiske: Homunculus strokes præsenterer sådan, at de har svaghed i alle bevægelsesretninger. Dette kan altså let udelukkes ved motorisk test. GBS er i højere grad en kombination af historie og fund (LMN syndrom og progressive problemer – generelt vil alle bevægelsesretninger også være påvirkede). Derimod vil forskellen mellem L5 og peroneus parese kræve en mere nuanceret undersøgelse af fodens evne til at invertere. Kan foden invertere, er der formentlig ikke tale om en L5 læsion.
Detaljer om “where is the lesion”
Du behøver ikke nødvendigvis større detaljegrad end overstående “gestalt / mønster” tegning. MAN KAN DERFOR HOPPE FØLGENDE AFSNIT MED TIPS OVER. Jeg vil dog gerne give dem, der er særligt interesserede, nogle ekstra hints til at udvide de enkelte “mønstre” på figuren herover.
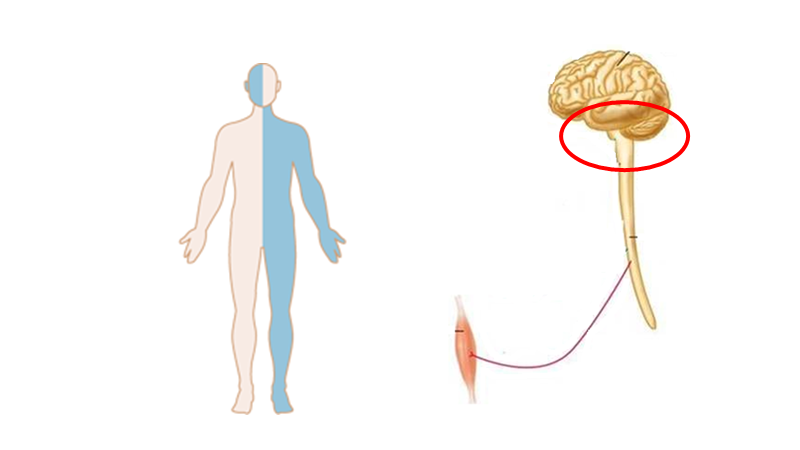
Hjernestammen
Husk der er to planer:
Horizontal:
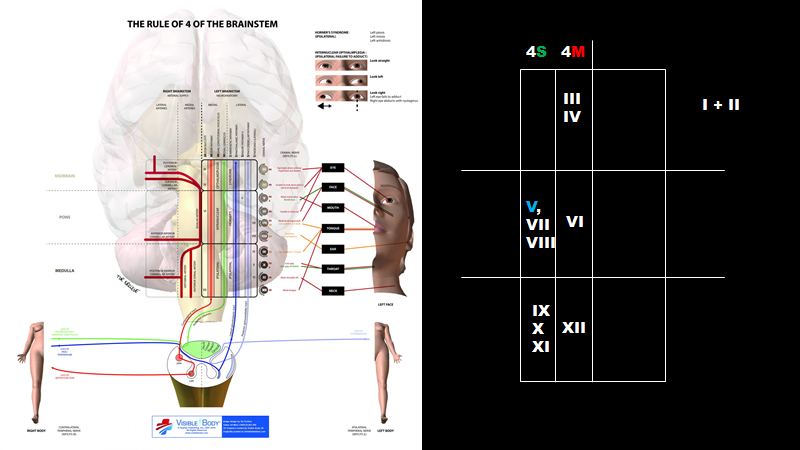
4S: laterale hjernestamme syndrom (sensorisk)
4M: mediale hjernestamme syndrom (motorisk)
Og vertikal (hver med 4 kranienerver):
Mesencephalon: III+IV (+ I+II, som dog ikke ligger samme sted)
Pons: V (går igennem alt) og VII, VIII og VI
Medulla oblongata: IX, X, XI, og XII
Glem ikke essensen over detaljerne herover: krydsede udfald = hjernestamme
Billedekilde: LITFL rule of 4 og egen produktion (til højre)
- Kendetegn: Krydsede udfald (ipsilateral: cerebellart-, sympaticus fx horners, og/eller kranienerveudfald , Kontralateral: motoriske/sensoriske udfald)
- Detaljer: Hjernestamme-læsioner kan forholdsvist let huskes vha “rule of 4”, som er velbeskrevet i LITFL og Gates, 2005: The rule of 4 of the brainstem: a simplified method for understanding brainstem anatomy and brainstem vascular syndromes for the non-neurologist. Kort sagt, opdeles hjernestammen i 3 vertikale dele (hver med 4 kranienerver), og 2 horizontale dele (hhv medialt og lateralt hjernestammesyndrom). Det laterale hjernestammesyndrom er kendetegnet ved de 4 S’er
Cerebrum (storehjernen)
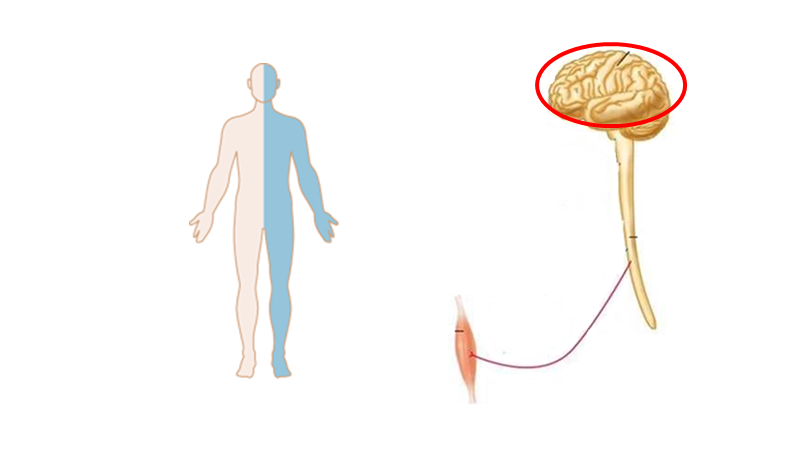
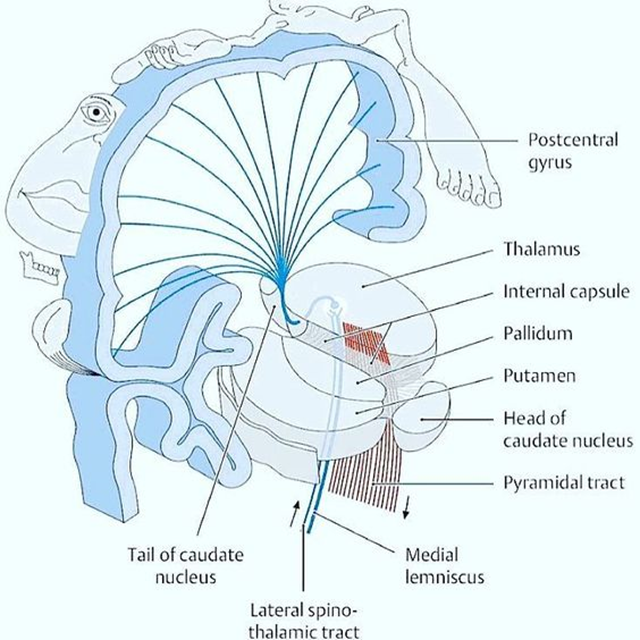
En person med hele ene side påvirket, men UDEN kortikale symptomer (fx afasi, central dysathri eller neglect), har som udgangspunkt capsula interna stroke.
Bemærk, at kortikale stroke er ordnet i humunculus ved motoriske / sensoriske udfald. Derfor ofte arm+ansigt eller ben+arm.
Bemærk, at små strokes kan ramme store humunculus områder og give “humunculus strokes” (fx en hel tommelfinger er ramt i alle bevægelser, er ikke perifær, men central!)
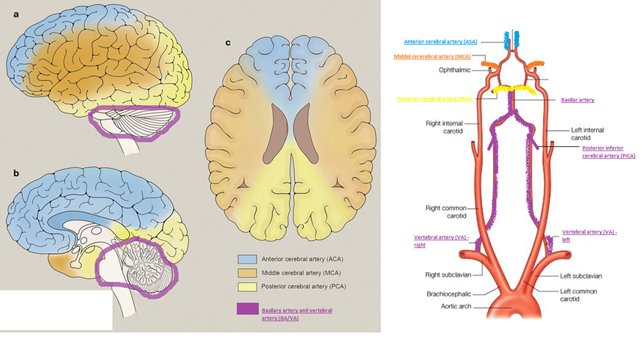
Bemærk, at jo mere proximalt et kar okkluderes, des større område afficeres (som at skære et træ ved stammen i stedet for ude ved grenene). De områder karene forsyner giver ophav til særlige “stroke syndromer” jf herunder
Disse strokesyndromer er en udvidet gestalt for at finde sandsynligheden for at patietnens læsion kan være vaskulær (ofte ved funktionelle patienter vil man finde, at deres hypotetiske læsion skulle være ALT for stor til at de stadig kunne være vågne og med GCS 15 tale med os)
Billedekilde: egen produktion med modifikation af google images billeder
- Kendetegn: Kontralaterale udfald – bemærk, at der findes “stroke-syndromer”, alt efter kar-forsyningsområderne. Der tales generelt om “bagre” (forsynet af a.basilaris, og aa. vertebralis)- og “fremre” (forsynet af ICA og kolateralter) strokes alt efter symptomatologien. Alt efter de store karområder ACA (anterior cerebral artery), MCA (medial cerebral artery) og PCA (posterior cerebral artery), findes syndromer, med undersyndromer, hvoraf en vigtig er PICA som giver et relativt hyppigt og klassiskt lateralt hjernestammesyndrom (Wallenbergs syndrom).
- Detaljer: er mange, og en dybere beskrivelse vil kræve hele neurologisk kompendium. Særligt vigtige ting at kende til i akutmodtagelsen er dog
- Kortikale symptomer: Som udgangspunkt er venstresidige strokes med afasi udfald (impressiv / ekspressiv), og højresidige med neglekt (favorisering af ene side af verdnen). Der findes et hav af andre kortikale udfald, hvoraf den eneste anden jeg vil nævne, er “personlighedsændring” / og “persefererende” adfærd (gentager øvelser), ved de frontale skader.
- Homunculus og capula interna: bemærk, at homunculus’en er dysproportionerlig repræsentation af kroppen afhængig af hvad vi anvender mest (neuroplasticitetsteori). Dvs tommelfinger og fod begge kan være “homunculus strokes” karakteriseret ved funktionstab i alle retninger (modsat perifære udfald). Bemærk, at alle “trådene” i figuren herover samles på et meget lille område (capsula interna), hvorfor man kan få ganske mange udfald (ansigt + arm + ben) med relativt små strokes. Disse er dog kendetegnet ved, at de IKKE har kortikale symptomer (afasi, neglegt etc), som passer sammen med deres i øvrigt voldsomme paretiske udfald.
Øjne- og øjensymptomer
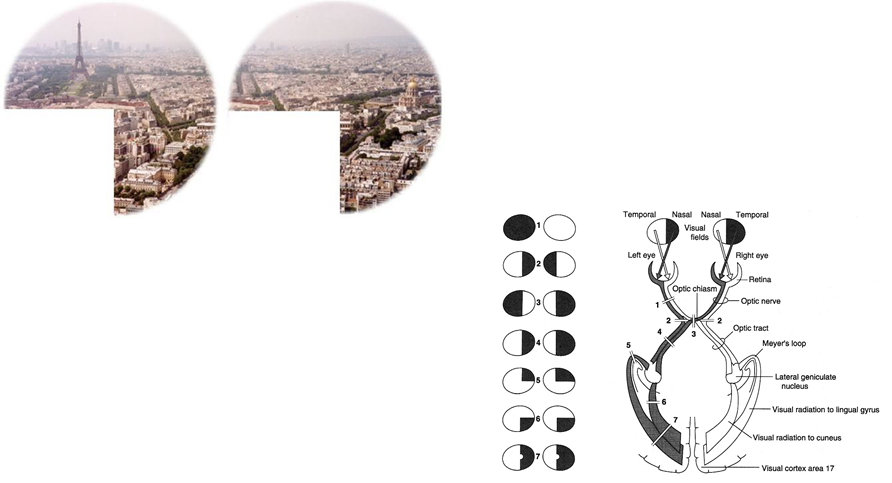
Har man derfor binocullært synsfeltsbortfald, må man nødvendigvist have en skade bag chiasma. Vender man dette om, monocullær påvirkning ofte oftalmologiske som udgangspunkt (om ikke tydelig anamense foreligger på fx amaurosis fugax, artertitis temporalis eller opticus neurit)
- Positive- og negative synsfænomener: Som udgangspunkt, kommer monokulære synsfænomener fra området anteriort for chiasma, og binocculære synsfænomener bag chiasma. Derfor er de fleste monocullære synssymptomer som udgangspunkt oftalmologiske (med særlig undtagelse af amaurosis fugax, temporalis arterit og opticus neurit). Det skal også bemærkes, at patienter med synssymptomer ofte er i tvivl om deres synsfænomener har været binocculære eller monocullære – har de ikke testet med en hånd for ene øje, er det ofte umuligt at være sikker, og man må forlade sig på andre dele af anamnesen.
Logisk giver dette mening, hvis du anvender dine to pege-fingre-spidse som et øje og peger dem begge fremad. Vinkler du den ene bare lidt, kan du forestille dig, at der ikke er samsyn længre – årsagen til vinklingen KAN være
– kranienerveparese (jf herunder)
– Noget der fylder op og trykker øjet væk (retrobulbær blødning, post-septal cellulit, TAO)
Billedekilde: google images
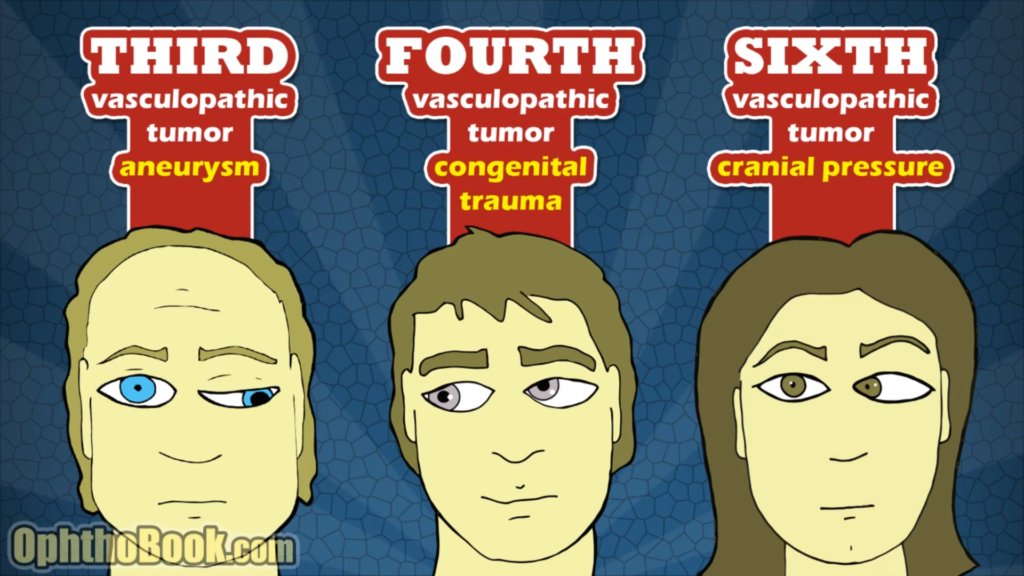
Overstående billede er fra TImroots ophtobook.com, og hans Super Eye Palsies-forelæsning på youtube og vimeo, som er højst anbefalingsværdig
Bemærk, at alle er i neutralposition (lettest at huske sådan, i stedet for at huske alle bevægelserne). Således er
– Kranienerve III (den farlige): Down’n’out, med “stor” ptose (modsat horners syndrom som er lille), mydriasis (modsat horners som er miosis). 3P’er findes: Partial, Progressive og Pupilinvolvement – disse 3P’er øger risikoen for aneurisme, særligt pupilinvolvering
– Kranienerve IV (den oftest benigne): Upward nasal shoot og tiltning af hovedet. Sjældent farlig, oftest traumatisk eller kongenit
– Kranienerve VI (blandingen): I neutralposition findes ofte en skelen inad på det paretiske øje. Åbenlyst kan pt ikke abducere dette øje (kig på det hvide i øjet på begge sider, og se om der er “lige meget hvidt”, eller om der er en “hvid trekant” tilbage på ene øjet når man kigger imod den paretiske side). Kan være øget intrakranielt tryk (tumor, IIH etc), men er oftest vaskulopati
–
Bemærk, at patienten KAN have palsies UDEN at det ses objektivt. Derfor er anamnesen (binoculær Vs monoculær – Vertikal Vs horizontal – Hvor forværres dobbeltsynet etc) ekstrem vigtig, og kræver konsultation med øjnelæge / neuroophtalmolog mhp klassificering
Bemærk, at en sjældnere men vigtig årsag til binocculært dobbeltsyn er temporalis arterit! (GCA)
–
Bemærk også, at multiple øjenpareser kan være pga
– Myasthenia gravis
– Sjældne tilstande i øjenkernerne (INO, one-and-a-half syndrom m.m)
– Sinus cavernosus syndrom
Billedekilde: Dr Roots Atlas
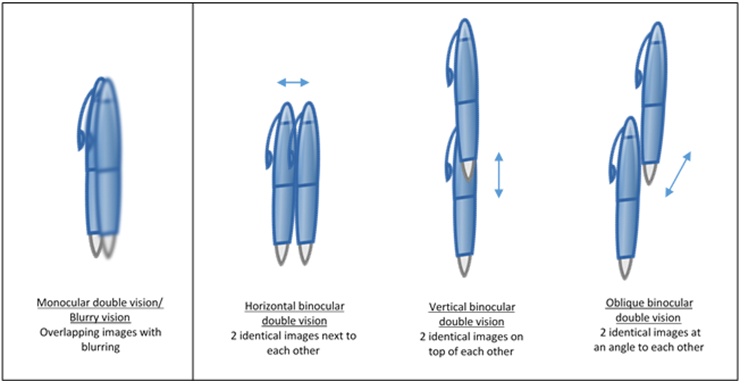
- Dobbeltsyn: Ligeledes skal der ved dobbelsyn skelnes mellem monocullært (dvs. holdes hånd for et øje, vil det ene se normalt, og det andet se dobbelt), og binocculært (hvert øje ser for sig ens, men samsyn er dobbelt). Igen er det hér næsten umuligt, at være sikker, hvis patienten ikke har testet med hånden for ene øje. Som akutmediciner, skal man være særlig opmærksom på de binocculære dobbeltsyn (begge øjne fungerer fint, men samsyn er dobbelt), da de kan være tegn på alvorlig og tidskritisk sygdom. Ved “ægte” binocculært dobbeltsyn vil patienten oftest klage over forværring af dobbeltsynet i særlig blikretning, og bedring i modsatte blikretning (øger sandsynligheden for patologisk årsag) . Patienten klager over “to billeder” enten vertikalt (når øjenen er vertikalt mis-aligned fx oculomotorious parese) eller horisontalt (fx abducens)). Bemærk, at anamnesen er ekstrem vigtig, da man ikke altid uden oftalmologisk hjælp, kan objektivisere mis-alignement af øjnene. Nogle særlige tidskritiske syndromer og diagnoser at være opmærksomme på ved binocculært dobbeltsyn er ( Se også: Tim Roots atlas – fx nerve palsy videoen ):
- 1) Occulomotorious parese (øje, der er down’n’out og evt med pupilinvolvering) – vil klage over . Overvej CT angiografi obs aneurisme – særligt ved pupilinvolvering
- 2) Abducens parese (Kan ikke abducere øjet) – særligt ved bilateralt må intrakranielt øget tryk overvejes (fx pga IIH eller tumor)
- 3) Sinus Cavernosus syndrom (flere øjenmuskel-kranienerver involveret på én gang)
- 4) Arteritis temporalis (kan ofte præsentere med dobbelsyn pga iskæmi i øjenmuskulaturen LR+ 3,5, LR- 0,96)
- 5) Oftalmoplegi pga fx Wernickes Encephalopati, MS (INO) , one-and a half, eight-and-a-half m.m
- 6) Lokal problemstilling (retrobulbær blødning, post-septal cellulit, TAO, m.m)
Billedekilde: egen produktion ud fra google images
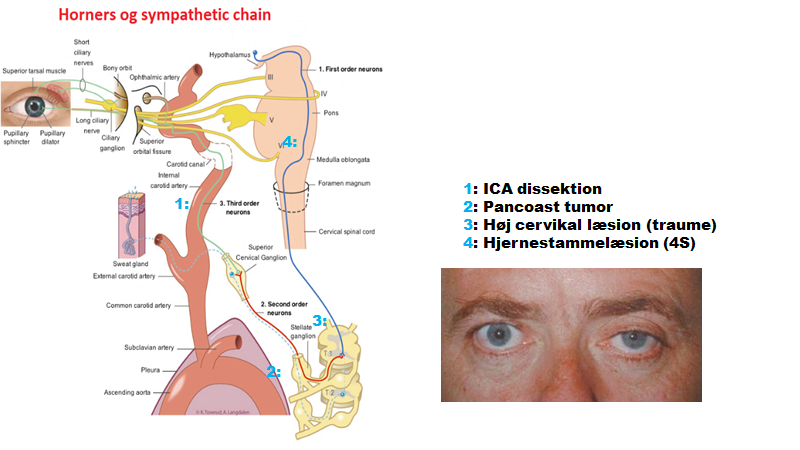
- Ptose og anisokori: De muskler der er involveret i øjenlågets funktion, er CN III (stor ptose ved læsion) og sympaticus (lille ptose, ved læsion). Åbning klares af CN VII (jf perifær pacialisparese). Nogen grad af Anisokori (forskellig pupil størrelse), forefindes i nogle studier i 20% af befolkningen. Man må som udgangspunkt overveje hvilket øje, der er miotiskt (lille pupil) og hvilken mydriatisk (stor pupil). Mydriasis er stort set aldrig farligt, medmindre patienten har GCS <15 og traume (obs hjerneblødning). I akutmodtagelsen er de derimod af ekstrem stor vigtigtighed at undersøge for miosis pga Horners syndrom (læsion af sympaticus – jf “horners U” herunder) – hvis man ikke tvinger sig til at undersøge for dette ved særligt hovedpinepatienter, så MISSER UD DET! (jeg siger ofte, at jeg hellere vil, at man undersøger for horners ved hovedpine patienter end næsten enhver anden test). Horners syndrom består klassisk af triaden / rime-remsen (eng): miosis, ptosis, anhidrosis – selvom anhidrose delen i akutmodtagelsen ikke har stor relevans (selvom mine neurolog-kollegaer kan være uenige). Ved horners (særligt “smertefuld / svimmel” horners – dvs smerte et sted i hovedområdet eller svimmelhedspatient med horners syndrom), overvejes følgende alvorlige årsager:
- ICA / VA dissektion (50% har horners – ofte som eneste udfald! jf Orr et al)
- Hjernestammelæsion (ofte stroke eller MS) eller høj cervikal læsion (ofte traumatisk)
- Mindre tidskritisk farligt: pancoast tumor i apikale lunge
- Ufarligt, men invaliderende: Hortons hovedpine
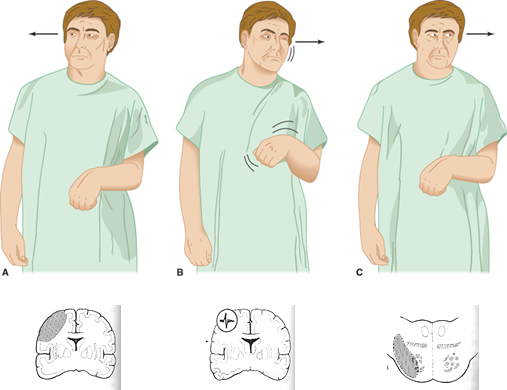
- Conjugeret blikparese: begge øjne peger i én retning, og kan IKKE komme over midtlinjen ved en “dolls eye”/ VOR-test. Kan patientens øjne komme over midtlinjen, må man overveje anden årsag fx neglekt (favorisering af en side). Årsagen til horisontal conjugeret blikparese kan let huskes ud fra følgende regel
- (stort) stroke i cerebral hemisfære: Patienten kigger imod sin læsion (forventet, at patienten er svag ipsilateralt – jf billedet til venstre herover). Undtagelsen fra denne regel, er pontine infarkter, hvor patienten kigger væk fra sit læsionen (billede til højre)
- Epileptisk anfald: Det epileptiske anfald “presser” øjnene imod modsatte side – patienten kigger væk frahvor anfaldet har foci
Medulla spinalis syndromer
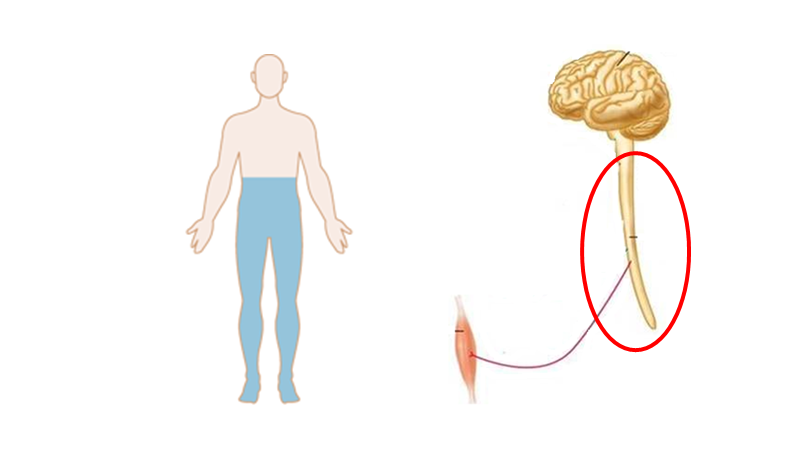
- Kendetegn: Para-symptomer (dvs bilaterale symptomer – fx paraparese), ofte med urin/sphincter-problemer, og UDEN kranienerveinvolvering (obs: horners syndrom er IKKE en kranienerve, og høje medullære lesioner kan give horners syndrom jf herover)
Disse kan være svære, men en let måde at tænke på dem på, er ved at forsimple anatomien lidt. Der findes kun tre baner, der går igennem medulla spinalis fra/til hjernen. To af hvilke krydser samme sted:
- Vibration-proprioception / sensation (blå – bagstrengsbanen) + motor (sort): Disse to krydser på samme niveau i hjernestammen, og følges ad i vertikal planet.
- Smerte / temperatur (spinothalamisk): Krydser på niveau, og fortsætter op til hjernen.
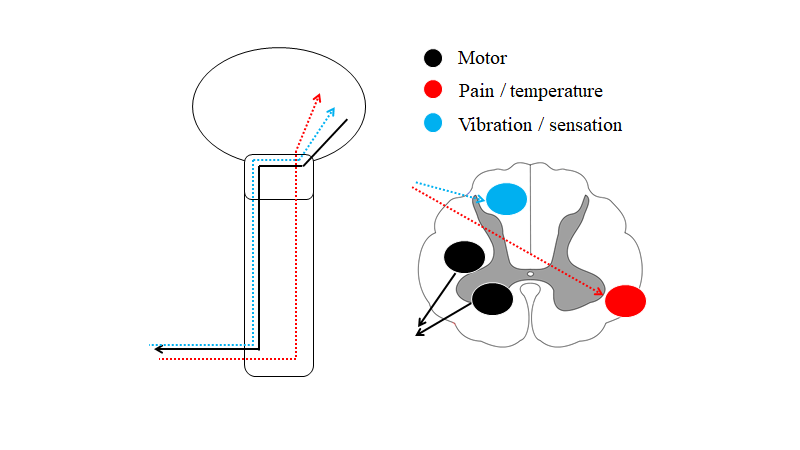
Kilde: egen produktion
Syndromerne: Ud fra overstående basale fakta, bliver det mere logisk, hvordan patienten præsenterer med diverse læsioner. I stedet for at kende detaljeret rygmarvsanatomi, opdeles patientens læsioner i særlige syndromer:
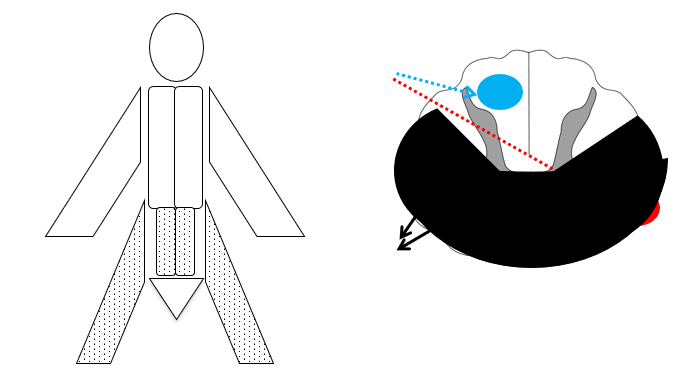
- Anteriort cord syndrom fx surferskade eller spinalis stroke: Bilateralt Tab af smerte/temperatur, samt paraparese – men intakt vibration / proprioception
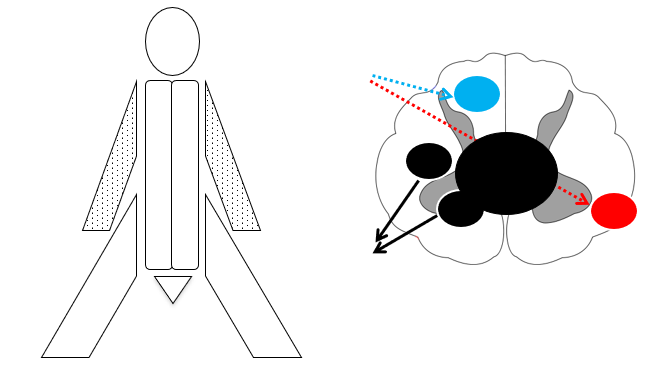
- Central cord syndrom fx hyperekstensionstraume i nakken eller syringomyeli: Initialt nedsat temperatur / smerte bilateralt -> senere nedsat kraft (armene pga neuroanatomisk fordeling af arme/ben i medulla spinalis). Såkaldt “man in barrel” syndrom
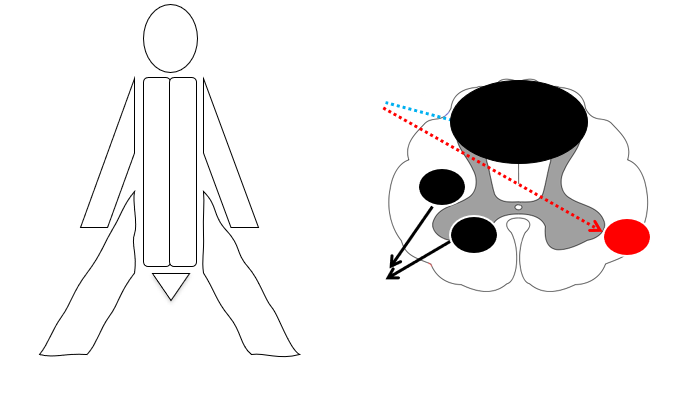
- Posterior cord syndrome fx B12: Nedsat vibration og proprioception bilateralt (patienten går ofte ind i ting / går fumlet, positiv rhomberg etc)
- Hemi-cord syndrome (brown sequard syndrom) – ofte traumatisk: Ipsilateral parese og vibration/proprioception tab, og kontralateral smerte/temperatur tab (se på den generiske figur i starten af dette segment og tegn den – så giver det til sidst mening)
- Total cord syndrome (tværsnitssyndrom, fx pga malignitet eller traumatisk): Komplet eller nær-komplet = Triade af paraparesis (spastisk under læsionsniveauet), “sensorisk niveau” (patienten føler der et “et bælte” omkring fx maven), og sphincter forstyrrelser
- Cauda Equina syndrome: Nedsat kraft uni-eller bilateralt, sensoriske udfald i ridebukseområdet og paretisk blære og nedsat sphinctermotorik
Perifære nerver
- Overordnede Kendetegn: Som udgangspunkt har komplette perifære nerveskader LMN-syndromet (hyporefleksi, nedsat tonus og senere atrofi og fascikulationer). Inkomplette (fx ved diskusprolaps) vil dog oftest ikke have LMN syndromet (og det et det man undersøger for ift vurdering af alvorlighed). Distributionen af som udgangspunkt distal (lange nerver skades først og den del mest distalt skades først).
Perifære nerverlesioner opdeles alt efter hvor på nerven skaden findes – og karakteristika er anderledes alt efter læsionen:
- Rødder: Kan have LMN syndrom. evt Radikulerende smerte / sensoriske problemer (dvs oppefra og ned) – bemærk, at smerten ved fx diskusprolaps ofte domineres af lokale smerter første 2 uger, og først derefter bliver radikulerende smerter tydeligere (selvom de har været der helt fra start). Hvis motoriske udfald, da oftest distale > proximale – fx rodprolaps, neuroborelia eller GBS. Konsistent med dermatom / myotom
- Myotomer: L5 = stå på hæl (ligner et L), S1 = stå på tå (ligner et S). L4 = squat
- Dermatomer: slå op i bog / hjemmeside oversigt før undersøgelse
- Plexus skader: som rødder men evt med sympatikus funktionsproblemer (nedsat svedtendens), og er IKKE konsistent med dermatom- eller myotom. Plexus skader er oftest trauamatiske (fx Erbs-Duchenne)
- Perifær nerveskade: Starter distalt på ben og siden hænder. Ved alvorlige tilfælde, kan de distale dele af nerverne fra ryggen som går frem på maven påvirkes fx peroneus parese, medianus eller ulnaris og radialus skader.
Der er mange overlappende klassifikationer af perifære nerveskader. Generelt opdeles de i
- Nervedistribution: Poly- eller mononeuropati (eller patchy = mononeuritis multiplex). Polyneuropati tyder på systemisk årsag (fx diabetes, alkohol eller nyreinsufficiens). Mononeuropati er oftere lokal årsag, og mononeuritis multiplex er oftest autoimmun / rheumatologisk / paraneoplastisk
- Type af skade: Axonal (permanent ødelæggelse) eller demyeliniserende (ødelæggele af myelin – ofte helt/delvist reversibel fx GBS)
- Type af udfald: ren motorisk (fx GBS), ren sensorisk (fx tidlig alkoholisk eller B12 mangel), ANS skader (fx ved diabetes og parkinson – erectil dysfunktion og ortostatisme) eller blandet (fx diabetisk)
Polyneuropatier
Generelt er polyneuropatier mangfoldige, men kendetegnet ved distal placering. Kan enten være axonale eller demyeliniserende, og kan være motoriske, sensoriske, ANS eller blandede (jf herover)
De hyppigste er sensoriske (“går på vat”), og er oftest alkoholisk, nefrogen (nyresvigt) eller diabetisk. Derefter starter de sjælndere, hvoraf den vigtigste for akutmedicienere at kende til, er B12-mangel (jf neuro NBV for videre udredning). Patienterne kan ofte være kendetegnet ved at have positiv rhomberg, og nedsat følesans for vibration fremfor alt på fødderne. I svære tilfælde endda på maven.
Der kan være smertekomponent med, hvilket kan henlede mistanke på small-fiber-neuropathy og enten kemo-behandlingsinduceret eller paraneoplastisk årsag
Primære ANS skader er sjældne, men ANS skader findes ofte ved parkinsons med ofte udtalt ortostatisme, samt diabetikere (fx erectil dysfunktion)
Den vigtigste at kende af de rent motoriske, er Gullian Barret Syndrom (GBS) som en demyeliniserende, rent motorisk progressiv polyneuropati (en undergruppe af AIDP: acute inflammatory demyelinising polyneuropathy). Husk at udføre og observere på Peak-flow og/eller tælle-test også kaldet “single breath test” (bed dem holde vejret og tælle så langt de kan – en bedside måling for vitalkapacitet – jf fx Kannikanan et al, 2014: Simple bedside predictors of mechanical ventilation in patients with Guillain-Barre syndrome). LP kan evt udføres på akutmodtagelsen, og er man langt fra neurologiske afdelinger, kan man opstarte IVIG efter konsultation. Endelig diagnose stilles ved EMG/ENG
Mononeuropatier
Typiske eksempler vi ser er fx carpaltunnel syndrom, traumatiske læsioner, eller dropfod, er hyppige – man må altid overveje “central” vs “perifær” lesion, og til dette behøver man at kigge på UMN Vs LMN symptomer (se senere), samt dermatom- myotom distributionen (kræver ofte et kig i en neurobog inden undersøgelsen). “vaskulopati“ som er hyppige årsager til øjenpareser, betragtes som en mononeuropati
En særlig mononeuropati, der kan være vanskelig, er “dropfoden“. Dropfoden kan stamme fra hele nervesystemet, og skelnes på følgende måde
- Cerebral læsion med dropfod: Kan ikke bevæge foden i nogle retninger (humunculus stroke) – bemærk, at det kan være svært at skelne dette fra n. sciatica skade ud fra objektiv undersøgelse alene
- L5 læsion Vs perifær dropfod (peroneus parese): Kan patienten invertere foden (tilsvarende supination i hånden), er der tale om en peroneus parese. Kan patienten ikke plantarflektere, er der tale om n.sciatica skade (jf Berkowitz 2018)
L5 Vs perifær skade er vigtig ift om man skal udrede for cauda equina eller alvorligt rodprolaps med motorisk involvering – derfor vigtigt for alle læger at kende til
Muskler og muskel-nerveovergange
- Kendetegn: proximale motorisk udfald (nb: nogle er så “proximale”, at de går op på ansigtet og øjnene – jf muskel-nerveoverangs tilstande som MG)
De to typer muskelproblemer er klinisk forskellige
- Muskel (myopati, myosit): Proximale, symmetriske motoriske udfald
- Muskelnerveovergange: kendetegnet ved “fatigue” (fx MG – myasthenia gravis = fatigue jo mere man anvender musklen eller Eaton Lambert syndrom (ELS) / “omvendt myastheni” = fatigue jo mindre man anvender musklen) – som øvrige muskelproblemer, desuden oftest proximale (“så proximale, at de går op til øjnene”).
Overvej altid medicinske årsager herunder paraneoplasi (fx dermatomyosit), hypoK+, PMR og atorvastatin, rhabdomyoylse og intoxication (boutolinom toxin m.m) osv
Neurologisk undersøgelse
Den “fulde” neurologiske undersøgelse
Den neurologiske undersøgelse skal betragtes probabilistisk, lidt som du vil blodprøver og andre tests, og hvor meget du skal udføre afhænger af din mistanke (din hypotese / præ-test sandsynlighed ud fra din anamnese). Den “fulde” neurologiske undersøgelser er altså en misnomer – om den er “fuld nok” afhænger af din bedømning af præ-test sandsynligheden (man kan dog i daglig tale måske kalde “screeningen” herunder med gennemgang af alle 6 punkter på et eller andet niveau, for den “fulde” neurologiske undersøgelse)
It is important to understand that the neurological examination can be used as:
– a screening test
– an investigative tool.It is used as a screening test when you examine a patient in whom you expect to find no neurological abnormalities: for example, a patient with a non-neurological disease or a patient with a neurological illness not normally associated with physical abnormalities, such as migraine or epilepsy. Neurological examination is used as an investigative tool in patients when a neurological abnormality is found on screening, or when an abnormality can be expected from the history. The aim of examination is to determine whether there is an abnormality, determining its nature and extent and seeking associated abnormalities
Hypothesis generation and testing: Whilst listening, think about what might be causing the patient’s problems. This may suggest associated problems or precipitating factors that would be worth exploring. For example, if a patient’s history makes you wonder whether he has Parkinson’s disease, ask about his handwriting— something you would probably not talk about with most patients.
Geraint Fuller, 2019: Neurological Exam made easy, 6th edition
Overstående er et eksempel på denne graderede neurologiske anamnese og undersøgelse (i tråd med probabilistisk tankegang, jf threshold modellen herunder)
While taking the history, the neurologist generates an anatomical hypothesis, which subsequently can be confirmed or rejected during the bedside examination. Following this, a working diagnosis is established and ancillary tests are chosen accordingly.
Kondziella et al, 2017: Neurology at the bedside 2. edition
Overstående perle fra Daniel Kondziella og Gunhild Waldemar, er i fuld tråd med vores probabilistiske tankegang. Hav vores “threshold model” i baghovedet imens du læser følgende afsnit

Billedekilde: Egen produktion
- Hvis du har lav præ-test sandsynlighed (fx patient med ikke-hyperakutte brystsmerter uden spontane neurologiske klager), behøver du bare at se patienten kan røre sig for at sige, at “normal neurologisk status”. Mange vil nok argumentere, at dette sker underbevidst, og ikke kræver formel test.
- Har patienten “et eller andet” neurologisk symptom (hovedpine, sensoriske forstyrrelser, svimmelhed), udføres oftest en “screening” af nervesystemet. Ved denne “screening”, vil man gå lidt dybere i undersøgelsen af det symptom patienten præsenterer med (fx motoriske forstyrreler , vil gøre, at man undersøger motorsystemet grundigere, og de andre systemer, der kunne være afficerede i de differentialdiagnoser man overvejer). Altsammen skal være ud fra din hypotese (anamnese-drevet).
- Har patienten særlige / specifikke symptomer, kan du udvide din screening med specielle undersøgelser (fx vil jeg ved den svimle patient særligt fokusere på horners syndrom, koordination og de specifikke nystagmus tests hhv HINTS eller BPPV provokationstests alt efter om AVS eller tEVS mistanke)
Du kan øve dig i overstående ved at spørge dig selv før hver patient du skal undersøge – hvis du kun fik 3 neurologiske undersøgelser, hvilke 3 ville det da være?
I min bog består den neurologiske screening af 6 dele (ofte kan disse laves ud fra “spontan undersøgelse”, og “formel undersøgelse” er derfor ikke altid nødvendig):
- Kognition og sprog: GCS 15, ingen dysathri, ingen afasi, orienteret x3
- Kranienerve gennemgang (husk rule of 4 – systematisk gennemgang af alle, er ikke nødvendig): Særligt fokus på CN VII, CN II,III,IV og VI, samt IX og X (ganesejlparese)
- Motorisk: Kraft-test (graderet på MRC skalaen fra 0-5) distalt og proximalt, tonus og trofik, reflekser (bemærk om hypo eller hyperrefleksi – bemærk, at “livlige reflekser” ikke er det samme som hyperrefleksi. Hyperrefleksi er patologisk, og vil ofte have andre UMN tegn, samt evt have øget refleksogen zone = reflekser udløses ved anslag på steder der ikke burde udsløse dem. Særligt vigtigt ved reflekser er, om de er ligesidige). Test for babinski (plantarrespons – dette kan gøres med chaddocs refleks eller den normale slags ved stryg under foden – husk du behøver ikke gå meget længere end lidt op ad hælen)
- Sensorisk: Berøringssans bilateralt (behøver ikke udvides til de øvrige modaliteter uden mistanke)
- Koordination: Chasing finger (ved tvivl laves flere tests som fx knæ-hæl og/eller linjegang) , rhomberg test for perifær ataxi
- Gang
Formel Vs spontan undersøgelse
Many components of a neurological examination can be observed in the initial moments of a patient’s interview
Latha Ganthi et al, 2018: Neurologic Emergencies – How to Do a Fast, Focused Evaluation of Any Neurologic Complaint, 1st edition
Neurologisk undersøgelse er IKKE bare den “formelle” undersøgelse, hvor du tester hver del hver for sig. Ofte er patientens “spontanrørelser” og “funktion-tests” mindst ligeså vigtige at bemærke (anvender de højre arm? rører de sig ataktisk?)
Fx kan kraften i overekstremiterne hos en patient bedømmes ved
- Formel test: Undersøg kraften momentarm for momentarm og bedøm ud fra MRC skala 0-5
- Formel screening test: Strakt arm test (pronerer patienten før 10 sek?) = grov motorik og/eller: “lav en bevægelse som hvis du skruer en pære i med fingrene” = fin motorik
- Informel / spontan rørelse: Rører patienten ene side ligeså meget som den anden ved fx armsving, når de skal op i sengen, når du sidder og taler med dem etc
- Distraktions tests / test af mistanke om funktionel tilstand: Strakt arm test, imens du tegner patienten i panden og beder ham/hende om at sige, hvad det er (funktionelle vil ofte holde armene oppe ved denne test, men tabe armene ved normal test. Bemærk også, at en sand-positiv strakt arm test kræver, at man pronerer og ikke bare taber armene, medmindre du har total paralyse)
Kendskab til overstående kan være særligt brugbart ved funktionelle patienter, samt patienter der er svære at undersøge. Neurologiske symptomer og tegn, der er pga skade på nervesystemet bør som udgangspunkt være permanente ved alle rørelser og i alle situationer (det betyder dog ikke, at patienten prøver at snyde dig, hvis der forefindes variabilitet!)
Forsøg derfor at undersøge i forskellige situationer hvis du er i tvivl (fx paitenten med drop hånd, der dog sagtens kan give dig et håndslag og når du vender hånden forholder sin hånd i “drop hånd” stillingen).
Forsøg distraktion af patienten og se om der er variabilitet i patientens undersøgelse (jf fx Stone og Hallets bøger og artikler på funktionelle neurologiske symptomer). Det er vigtigt at nævne, at patienten IKKE gør dette med vilje – det er ubevidst og invaliderende for dem (jf Susanne O’sullivan – it’s all in your head, og Neuro NBV – funktionelle symptomer)
Hieraki i undersøgelsen
Nogle tegn er vigtigere end andre. Subjektive tegn som sensoriske udfald, er helt op til patienten selv og svære at objektivisere. Derimod er motoriske fund noget vi kan se og bedømme. Nogle spontant forklarede sensoriske symptomer kan dog være foruroligende og kræve meget nøje undersøgelse af alle sensoriske modaliteter (fx “bælte omkring maven” = obs myelit, “riddebukseområdet” = cauda equina)
Sensoriske udfald er dog som udgangspunkt af mindre værdi, end motoriske undersøgelse. Den neuroanatomiske distribution kan evt hjælpe (jf også Lin et al i slutningen af dette blog indlæg, for hierakisk opdeling af stroke-symptoemr)
Visse ting, er man nødt til at tvinge sig selv til at lede efter – fx horners syndrom ved hovedpinepatienten (er ofte vigtigere, end den “fulde neurologiske undersøgelse”)
Isolerede fund
The focus should be on the principal symptoms and signs; the neurologist should not let minor findings and uncertain clinical data distract from the greater picture. (Admittedly, this is not easy without experience.) If the patient has many different and seemingly unrelated complaints, it is useful to ask what bothers him most and then concentrate on this complaint.
Kondziella et al, 2017: Neurology at the beside, 2. edition
Find dit fagans nomogram frem igen:
Isolerede fund som fx isoleret babinski, skal ALTID bedømmes ud fra
- 1) IRR – interrater reliability (var tegnet i virkeligheden der, eller er det bare mig der er en “dårlig test”?)
- 2) præ-test sandsynligheden – hvis tegnet var der, hvad betyder det så (hvad er LR for babinski?)
Positiv babinski har formelt en k-værdi (IRR) på 0,17-0,60 (= dårlig til moderat) og en LR+ på 8,5 (sens 9-45%, spec 98%) – Steve McGee 2017: evidence based physical diagnosis . Vi vil som regel forvente andre tegn på UMN syndrom (1. neuronskade) ved positiv babinski (fx hyperrefleksi, spastisk tonus etc), men lad os sige, at det er et isoleret fund. Hvad gør dette ved forskellige præ-test sansynligheder (udregn vha Fagans nomogram eller på Getthediagnosis.com ‘s calculator?
- Patient 1: 0,5% præ-test sandsynlighed for all cause UMN (generøs vurdering hos ung patient med brystsmerter): post-test sandsynlighed på 4% (dvs 96% har ikke UMN)
- Patient 2: 10% præ-test sandsynlighed for all cause UMN (fx ung patient med følelsesforstyrrelser i ene ben kommet over dage): Post-test sandsynlighed 49%
Går vi ud fra, at babinskien er reproducerbar af flere læger (IRR), og gerne med forskellige tests (klassisk babinski, chaddocs sign etc), skal begge overstående patienter nok udredes. Men patient 1 behøver ikke at udredes akut, men kan måske få MR undersøgelse via egen læge eller opfølgning. Patient 2 skal umiddelbart udredes hurtigere.
Uanset hvad, skal isolerede fund dog ses i helheden (ud fra præ-test sandsynligheden og gestalten / den neurologiske hypotese)
Journalføringen tips
Beskriv altid det du ser – gerne også når du ikke er i tvivl: Når neurologer eller andre læger sidder med din patient dagen efter, ved de ikke hvor god du er til at bedømme neurologi. Skriver du derfor i din journal bare “afasi” eller “central facialis parese”, uden at forklare de motoriske udfald, der er til grundlag for din bedømmelse, og patientens symptomer dagen efter ved stuegang er gået væk (og de ikke selv kan forklare hvad der skete), står man med et problem. Skal man stole på lægens bedømning af isoleret central facialis parese hos denne unge patient på 30 år, og derfor give en stroke diagnose? Beskrives, hvad man ser, er der mindre tvetydighed, og lægen efter dig, kan bedømme bedre. Husk, at objektiv undersøgelsen jo er OBJEKTIV, og hvis man skriver “central facialis parese”, vil det være en fortolkning. Gem dette til konklusionen! (“motoriske udfald i ansigtet bedømmes som central facialis parese, og patienten indlægges derfor til stroke udredning med ASA / clopidogrel loadning efter CT cerebrum uden blødning”)
Jævnfør ALTID med tidligere undersøgelser i journalen: At have en tidligere velbeskrevet neurologisk undersøgelse i journalen på en patient er ligeså meget værd, som at have et tidligere EKG på en patient med brystsmerter. Det er med andre ord GULD VÆRD!. Derfor er det altid en god idé at skrive hele din neurologiske status på patienter, der kommer med neurologiske præsentationssymptomer – om ikke andet, så er det godt for den næste gang de kommer ind. Vigtigheden af dette kan eksemplificeres ved følgende: Din patient har hovedpine med anisokori og noget der ligner mild ptose. Patietnen har ingen tidligere billeder af sig selv hvor man kan se øjnene godt nok til at vurdere (20% af befolkningen har nogen grad anisokori – afhængig af lysforhold Lam et al, 1987: The prevalence of simple anisocoria). Hvis det står i tidligere journaler, at patienten har haft tydelig anisokori, kan man spare dem en angiografi for dissektionsmistanken.
Et andet eksmpel er meget typisk: Ældre patient med tidligere stroke i højre hemisfære kommer ind med svaghed i venstre side. Hvordan ved vi, om det er nyt eller gammelt? Er det post-stroke recrudescence, geriatrisk dekompensering med forværring af tidligere svaghed, post-epileptisk svaghed (Todds), migræne-hemiplegi eller et nyt stroke? har vi ingen tidligere journaloplysninger på patienten om graden af svaghed ved første stroke og hvor gode de har været efterfølgende, må vi tænke, at patienten har stroke igen. Ved vi derimod, at patienten havde MRC 2/5 i venstre arm ved første anfald, som efterfølgende blev bedre til MRC 4/5, og nu har patienten MRC 3/5, så er det usandsynligt, at dette er et nyt stroke, men derimod snarere en anden årsag
Særlige hints ved neurologiske tegn (se også neurous.dk og fuller, 2019):
Funktionelle neurologiske tegn (FND)
Jeg har i nogle måneder arbejdet på en blog om dette emne, og vil derfor vente med at gå for meget i detaljer.
Lad mig blot lufte min holdning til dette ekstremt vigtige emne med en quote fra den fantastiske og empatiske bog af Suzanne O’sullivan på emnet:
If we really want this situation [red: undererkendelsen og den fortsatte invalidering og stigmatisering af funktionelle tilstande og menneskerne bag dem] to improve then we each have a contribution to make. There is room for change in all of us. Doctors should be less afraid of this diagnosis, more willing to confront it and more compassionate to the sufferers[…] Medical professionals need to stop placing this unqualified diagnosis right at the bottom of their list[…] Instead of appearing as a footnote in medical textbooks, psychosomatic disorders should be acknowledged as a serious diagnosis in their own right. But most of all society, the general public – you! – need to stop regarding symptoms of this sort as in some way less “real” than those associated with other diseases”
Suzanne O’Sullivan, 2016: it’s all in your head, s 311
Dette er ikke en lille gruppe – i studier involverer det fatkisk 30% af praksis befolknignen. Det er formentlig den største gruppe vi ser, og deres “tilstand” er på et spektrum fra “let somatiserende” til “svært funktionshæmmede (funtionelt syge)”.
Dette kan logisk anerkendes probabilistisk når du spørger dig selv: Når din patient med thunderclap headache (TCH) nu ikke havde nogen alvorlig årsag…hvad var så? (tænk over bio-psyko-social modellen i dit svar). Skal vi tale med patienten om det?
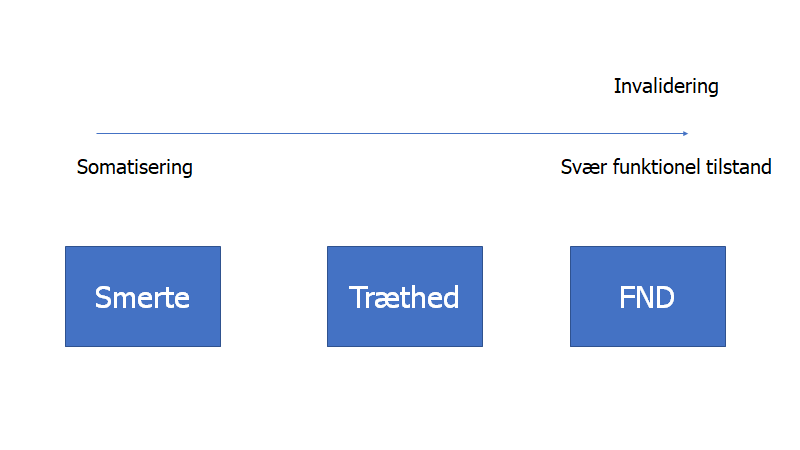
Tilstanden er ikke bare FND (functionel neurological disorder), men også smertepatienter og træthedspatienter (CFS / ME). Tilstandene kan kun forstås ud fra bio-psyko-social modellen (ligesom alle tilstande i virkeligheden vi møder!). Og måden vi imødekommer og kommunikerer med denne store gruppe af patienter, kan formentlig forværre deres symptomer:
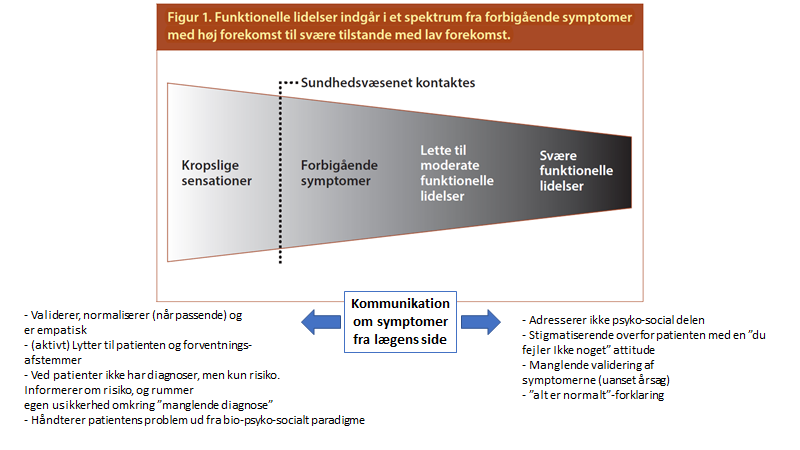
Kan du ikke vente på bloggen, så anbefaler jeg at starte med Suzanne O’sullivans bog.
Facialis paresen (central vs perifær):
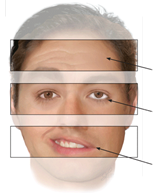
Klassiskt kigger man på panden (centrale kan stadig rynke panden – modsat perifære). Hvis den perifære parese dog er mild eller under udvikling, kan det være ekstremt svært at bedømme. Det er derfor særligt vigtigt, OGSÅ at kigge efter patietnens spontane blinke-evne. Ved perifær facialis parese blinker patietnen ikke så meget spontant på afficerede side. Hvornår en perifær facialis parese skal lumbalpunkteres? se neuro NBV
Sprogproblemer:
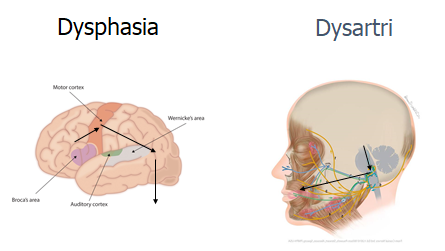
- Undgå at kalde afasi for afasi før du ved det (jf framing bias, premature closure og “beskriv hvad du ser” herover).
- Forskellen mellem afasi (dysphasia) og dysathri, er, at afasi er en læsion i sprogområdet i hjernen (langt oftest på højre side), og giver kortikale symptomer. Derimod er dysathri et mekanisk problem, hvor den motoriske bevægelse / koordination der skal skabe sprog er skadet.
- Afasi kan udredes ved 3 enkelte spørgsmål: 1) taler patienten flydende sætninger (hvis ja, da ej ekspressiv afasi), 2) kan patienten følge fler-ledsopfodringer (fx peg på taget -> peg på gulvet -> peg på stolen – uden at du gestikulerer det til dem) (hvis ja, ingen impressiv afasi), og 3) kan patienten gentage efter dig (sjældne konduktions afasier)
- Dysathri skal tænkes som motorisk læsion (jf tegning herover med pilene fra det røde motor cortex område -> cerebellum / hjernestammen -> tunge/ansigtsmuskler/larynxmuskler). Hvert sted på vejen kan læderes, og det vil give anledning til særlig type dysathri
- Spastisk /central dysathri (Motorisk cortex): klassisk lyder det som patienten har en kartoffel i munden og langsomt – eksempler kan findes hér og hér) – jeg tænker altid på Riget’s “Det er uuuuhhyyygggelliiigt”
- Slap /perifær dysathri (motorisk perifær skade – eller bare alkoholpåvirkning eller lokalt problem med tungen/munden): Man taler med luftspild og “flappende” lyde fra kinder / mund / tunge (lidt som Daffy Duck)
- Andre dysathrier: der findes andre sjældne dysathrier som ses indenfor afdelingsneurologien fx ataktisk dysathri (også kaldet “scanning speech”, fordi man udtaler alle vokaler i et ord og taler “sta-ca-to”)
Upper motor neuron Vs lower motor neuron syndrome (1. og 2. neuronskade):
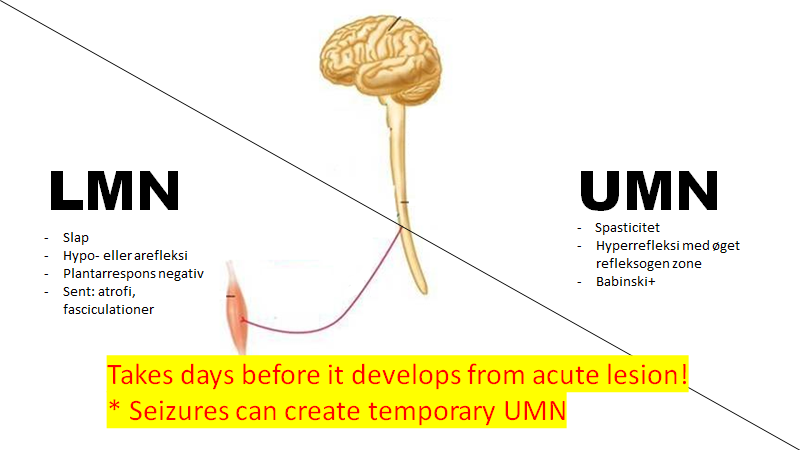
Har patienten haft symptomer i mere end nogle timer til dage, kan man ofte skelne mellem centrale (1. neuronskade) og perifære (2.neuronskade) læsioner ved disse to syndromer:
UMN syndromet udvikles først efter timer til dage efter en central læsion (undtagelse: epileptisk anfald): Hyperrefleksi evt med øget reflexogen zone, babinski positiv, spastisk tonus
LMN syndromet er rent mekaniskt og udvikler sig ganske hurtigt efter læsionen: Slap tonus, hypo- eller arefleksi udvikler sig hurtigt (rent mekanisk), imens (eksempler: Guillian Barret Syndrom, perifær nerveskade)
Rhombergs test og ataxi: Ataxi (koordinationsforstyrrelser) findes i central form (cerebellar ataxi) og i perifær form (proprioception). At vi kan stå, afhænger af syn + proprioception + balanceorganet. Teorien ved en Rhombergs test er, at én af de tre allerede er læderet (proprioception = fx polyneuropati ved diabetes; balanceorganet = vestibularis neurit). Når du stiller din patient op, kan de stå med åbne øjne, men når de lukkes, fjerner du pludselig to af de tre balance-givende elementer, og patienten tager et skridt til siden eller vælter indenfor 10 sekunder. Dette er en positiv rhomberg, og tyder på PERIFÆR skade. Central ataxi derimod vil uanset hvad ikke kunne gå ordentligt fra baseline – rhomberg testen, vil derfor ikke kunne fortolkes.
Reflekser, er en af de vigtigste tests for at skelne mellem UMN og LMN syndromet. Her skal det nævnes, at “hyperrefleksi” er som udgangspunkt patologisk, men “livlige reflekser” er normalvarianten, hvor patienten bare har lidt mere let-anslåede reflekser. En måde at skelne mellem de to, er ved “udvidet reflexogen zone” – hvis patientens reflekser enten er
- Udvidede reaktion: anslag af en refleks giver udslag på enten den anden side (krydsede reflekser) fx ved patella refleksanslag, hvor det andet ben gipper eller i form af fx finger-sammentrækning ved bicepsrefleks
- Udvidet udløsning: Her forstås at en reflex udløses ved anslag et sted på kroppen, hvor man ikke ville forvente det. Fx hvis patella reflexen udløses ved anslag op og ned af anteriore side af underbenet – jo længere væk fra patella-reflexens normale sted, des mere sikkert patologisk
- Pseudo udvidede reflekser: svært nervøse / ængstelige patienter (i min erfaring ofte ældre, tynde kvinder) kan ofte have have en reaktion ved anslag, hvor hele kroppen “gipper” / spjætter. Som udgangspunkt er dette nok nærmere pga andre ikke-neuroanatomiske årsager som fx “sentitivering” af patienten (“føler mere end andre”).
Igen, handler det alt sammen om præ-test sandsynligheden og helhedsbedømmelsen. Finder du isolerede livlige reflekser med en grænse-udvidet reflexogen zone, men uden andre UMN syndrom tegn, så er det nok bare et individ, der har meget livlige reflekser.
Bevidsthedstab (LOC – loss of consciousness og TLOC – transient LOC):
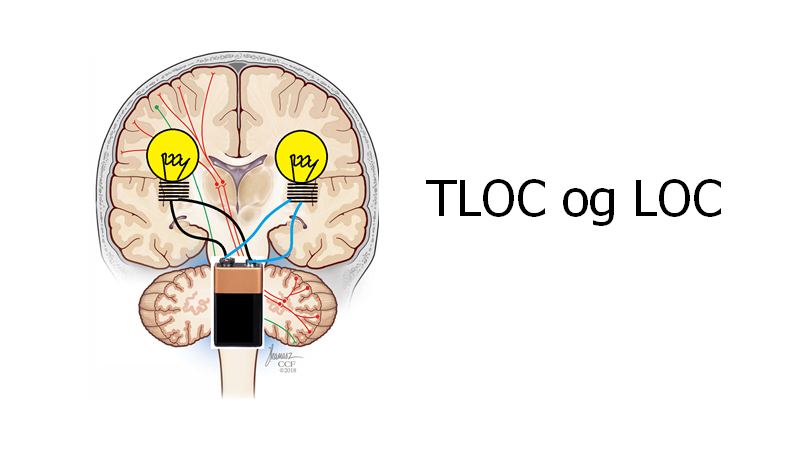
Jeg kommer til at lave en blog om dette på et tidspunkt, men indtil da vil jeg blot forklare et enkelt principt ud fra overstående billede. Der er to årsager til, at man mister bevidstheden (LOC)
- 1: Påvirkning af ARAS systemet i hjernestammen (batteriet går ud) – fx ved top of the basilar syndrome (evt pga a. basilaris trombe) eller cataplexi
- 2: Påvirkning af bilaterale hjernehemisfærer (lyset går ud i BEGGE pærer samtidigt)
De neurologiske årsager til, at man får LOC gør, at man bliver liggende og/eller er sænket i sin GCS.
Stroke er derfor næsten aldrig differentialdiagnose til patienten med TLOC! (ekstremt sjældne undtagelser: fx TIA i percheron arterie, der forsyner begge hemisfærer; stuttering TIA i basilaris området)
Desuden
Hvis en patient har krampe-anfald (anfald med motoriske bevægelser og bevidsthedspåvirkning) i begge sider af kroppen, men der er flere features der får det til at virke dissociativt (jf tabeller herunder), er mit bedste råd følgende: Tag dem i hånden, og tal med dem. Giver de dig øjenkontakt og evt kan svare, så er det usandsynligt, at det er epileptisk, og snarere PNES (psykogen non-epileptisk seizure – som nok hellere bør kaldes “dissociative kramper”). Ud fra vores “pære-model” herover er det nemlig umuligt, at patienten kan tale med dig og give øjenkontakt (være bevidst) samtidig med at de har et krampeanfald i begge sider (begge hemisfærer involverede) (undtagelse: sjældne frontale epileptiske anfald – men de vil oftest give stereotype svar. I sidste ende er det dog en vEEG der kan afgøre om et anfald er dissociativt eller ej)
Bemærk desuden, at patienten dog ikke er mere bevidst om end et epileptisk anfald (det er det terapi går ud på!)
P (patient): You think it’s all in my head
S. 47, It’s all in your head (Suzanne O’sullivan, 2016). Formentlig eksempel på alexithymi (bemærker ikke egen stress – derfor kommer den netop ud som kropsligt symptom – dette er formentlig patofysiologien bag mange funktionelle tilstande). Bemærk, at patienten IKKe er bevidst om sine symptomer, under anfaldende
Dr O’Sullivan: no, P, I know your seizures are real. They are real, but they are arising in the subconscious rather than being due to a brain disease. Dissociation means that a sort of split has occurred in the mind. Your conscious mind separates from what is happening around you. That detachment means that one part of you doesn’t know what the other is doing. But it’s not deliberate. You cannot make yourself unconscious any more than I can deliberately blush og produce tears
P: I understand. I just don’t understand how any of this applies to me. I’m not stressed. My life has never been better.
LOC har derfor en hel anden differentialdiagnoseliste, selvom der til tider kan være overlap (særligt i epilepsi-tilfælde)
TLOC derimod er en midlertidig påvirkning af begge hjernehemisfærer pga nedsat blodflow (begge pærer går ud) – ved besvimelsen oprettes dette, og patienten kommer op uden forsinkelse (medmindre man har slået hovedet slemt nok). Differentialdiagnoserne er hér kardiogen synkope, Epileptisk anfald, PNES og vasovagal synkope og ortostatisme.
[Proxy anamnese] Remember: when a patient cannot report all events himself or cannot give a history adequately for another reason such as a speech problem, it is essential to get the history from others if at all possible, such as relatives, friends or even passers-by. If you cannot see them in person – call them on the telephone!It is better to get an exact description for specific events, particularly the first, last and most severe events, rather than an abstracted summary of a typical event.
Geraint Fuller, 2019: Neurological exam made easy, 6th edition
Vurderingen af denne patiengruppe gøres bedst ud fra
- Anamnese der vurderer præ-iktal, iktal og post-iktal anamnese (da differentialdiagnoserne epilepsisk anfald, kardiogen synkope og vasovagal/ortostatisk synkope oftest kan skelnes ud fra disse
- Proxyanamnese (spørg vidner) – anvend tid til dette og ring op til dem!
- Risikobedømning ud fra beskrivelse (jf high risk Vs low risk features for kardiogen synkope) – da der ikke altid findes vidner. Jf Brignole et al, 2018: 2018 ESC Guidelines for the diagnosis and management of syncope
- Forsøg på at få nogle tegn der peger i en særlig retning (ofte ruling out by ruling in)
- Specifikke for epileptisk anfald: laterale tungebid eller tydelig postiktalitet, positiv babinski efter anfaldet eller todds parese – obs MANGE af disse tegn er uspecifikke (ethvert tungebid, fæces/urin afgang, laktatstigning etc), og ses ved de andre differentialdiagnoser også
- Kardiogen: hvis ingen EKG tegn (jf Fainting Dead Away – Cardiogenic Syncope | The Heart Course på youtube), og historien ikke sikkert kan skelnes fra epilepsi (youtube: Inducing syncope: the fainting lark), findes ingen tegn der ruler kardiogen ud
| Præ-iktalt | Iktalt | Post-iktalt | |
| Vasovagal | Prodromal følelse af utilpashed | Ofte myoklonier | Medmindre slag imod hovedet, on/off (oppe efter sekunder) |
| Epileptisk anfald | Sjældent (evt cry, epigastric rising etc) | Oftest: åbne øjne, rytmiske stereotype bevægelser | Ofte post-iktal forvirring og/eller todds parese |
| Kardiogen | Sjældent (evt palpitationer, brystsmereter) | Ofte myoklonier (kan for lægmand se ud som kramper) | Medmindre slag imod hovedet, on/off (oppe efter sekunder) |
| Dissociativt anfald (PNES) | Ofte dissociations-symptomer eller emotional stress (dog uspecifikt – kan også trigge epilepsi) | Waxing and waning Evt lukkede øjne, ”kastende” horizontale og asymetriske bevægeler Går at bryde ved at tage deres hånd og forsøge at tale med dem | Variabelt |
Forvirring, amnesi og psykose
Forvirring har som udgangspunkt ikke noget med neurologi at gøre, ved ældre patienter. Selvom mange neurologiske tilstande kan give forvirring, så skal der være mere der taler for neurologi, før man går efter dette (fx historie om kramper / epilepsi = post-iktal, eller fokale udfald = stroke eller Todds parese). Ofte vil disse patienter være delirøse, have BPSD eller på anden vis være “geriatrisk dekompenserede” (jf geriatrisk akutmedicin blog del 1 og figuren herunder fra Clegg et al, 2013).
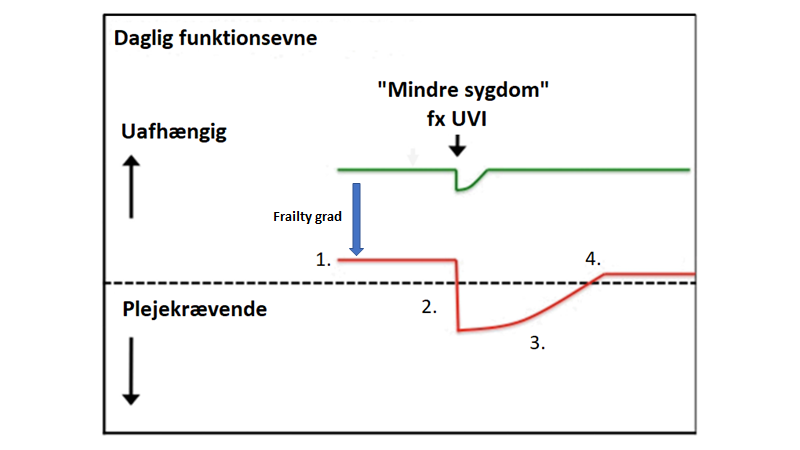
Ældre med tiltagende frailty (rød linje) falder i basalt funktionsniveau til et punkt, hvor mindre og mindre stressorer (fx UVI) får dem under “dekompenseringslinjen“,og skaber et uproportionerligt stort fald i funktion (2.) , som de sjældent kommer sig helt fra (4.), og at komme sig fra det tager længere tid (3.)
Patienterne præsenterer med “dekompenserings syndromer” fx non-specific complaints, delir eller fald
Ofte er disse patienter hjememboende, og dekompenserer nu for første gang (“pludseligt forvirret”) pga en mild infektion, som af-maskerer deres underliggende frailty, som af familien ikke altid er åbenbar (“jamen hun plejer jo at kunne klare sig selv”)
Konklusion: ved forvirring (obs delir) må man altså udrede medicin delen først (polyfarmaci, dehydratio, infektion eller anden alvorligere årsag)
Modificeret fra Clegg et al, 2013 –
Pludselig amnesi er lidt oftere neurologisk – Unge patienter kan have dissociation, men både WE (wernickes encephalopati), NMDA-encephalit / paraneoplastisk syndrom og TGA (transitorisk global amnesi – som per defintion skal være ovre indenfor 24 timer)
Pludselig psykose / forvirring uden tidligere psykiatrisk historie særligt ved yngre patienter kan udover medicinske årsager (intoxication, hypoglykæmi, B12 mangel etc) og primær psykiatrisk årsag, have neurologisk / neuro-infektiøst årsag (WE, NMDA encephalit, HSV1 encephalit, fokal epilepsi, neurosyfilis, neuro SLE m.m), og må umiddelbart udredes ofte med lumbalpunktur
Fælles for alle overstående er dog, at der ofte skal være ganske tydelige symptomer eller andet der øget præ-test sandsynligheden for neurologisk årsag
Forværring af tidligere neurologiske symptomer
Lidt som i endokrinologi hvor tilstande forværres ved feber (diabetes og addisons), så har neurologiske sygdomme ofte forværring ved enten “geriatrisk dekompensering” (se herover), og/eller feber.
Det mest kendte er MS’s uthoffs fænomen ved varme /feber (såkaldte pseudo-attaker), men måske mindre kendt er post-stroke recrudescence: arret fra tidligere stroke gør, at ved infektion kan det man har rehabiliteret op gennem tiden siden stroket, pludseligt krakelere ved stress på systemet. Dette er i overensstemmelse med geriaternes heuristik “det svageste organ ryger først ved stressorer”. Det er vigtigt, at patientens symptomer ikke er VÆRRE end tidligere (fx hvis initiale stroke var styrke 3/5 og nu 1/5 må man overveje nyt stroke), og er i samme side! – af samme grund er tidligere journal med neurologisk undersøgelse uvurderlig. Dette er ofte åragen til “patienten der hænger til ene side” fra plejehjemmet ved infektion. Lignende kan parkinson, også forværres i sin parkinsonisme under infektion eller anden stressor, og epilepsi har ændret tærskel ved stressorer (søvnmangel etc)
Pas på ikke at anchor på de neurologiske “tydelige” symptomer, og grav i stedet årsagen frem
Bedømmelse af øget intrakranielt tryk (ICP)
De færreste patienter præsenterer med kvalme/opkastninger og nedsat GCS ved øget ICP. Der findes flere metoder til at bedømme ICP, og ved mange hovedpine patienter kunne dette være et godt værktøj, som muligt kan reducere mængden af skanninger
Oftalmoskopi
Denne test har ekstrem dårlig IRR i ikke-oftalmolog hænder, og selvom alle bøger forklarer, at man skal kunne det både i neurologi og akutmedicin, så kræver det i min erfaring i hvert fald indkøb af “Welch Allyn PanOptic oftalmoskop” (eller lignende) for at kunne bedømmes ordentligt. Det du leder efter, er nemlig
- Tab af SVP (spontaneus venous pulsation) – tidligt tegn. Ifølge Kondziella et al: “With some practice, SVPs can be detected in nine of ten people”
- Papilødem – sent tegn
Jeg har endnu ikke fået det ind i mit rutine, men man kunne formentligt købe ét godt oftalmoskop for alle de dårlige der findes på din akutmodtagelse, og anvende det!
LP med trykmåling
Vi har længe talt om emnet i YDAM-forum, og min holdning er, at ved patienter betragter som høj nok sandsynlighed til at lave LP på, kan man ligeså godt lave en tryk-måling (særligt for at fange IIH, SIH og sinus vene tromboser). Biblen indenfor procedurer i akutmedicin: Robert’s and Hedges clinical procedures, anbefaler også trykmåling, men ud fra hvad der virker til ekspertbedømning
Det er altså problematisk, at vi ikke har kunnet finde nogle studier på LR+/- ud fra trykmålingen – derfor kan det være svært at vide, hvornår testen er falsk-positiv / negativ og dens anvendelighed i det hele taget. I min erfaring (lav evidens), har jeg trods hunredevis af LP’er med trykmåling, primært på TCH (thunderclap headache) patienter ikke fået svar, der ledte mig i en anden diagnostisk retning. Jeg vil dog fortsat anvende den i min klinik – om ikke andet fordi det er en let prøve til måske at fange de sjældne sinus vene trombser der præsenterer med thunderclap headache (TCH) – ca 5-10%, når jeg alligevel er i gang med at lede efter xantochromi.
Skal du lave trykmåling, skal patienen ligge, og gerne have udstrækte ben når du finder rummet og måler (for at mindske valsvalva) – Anæstesiologerne bliver til tider nervøse når jeg fortæller dette, så jeg plejer at trække lidt fra trykmålingsresultatet alt (LAV GERNE ET STUDIE PÅ TRYKMÅLINGEN – we just don’t know!). Patienten skal hoste når måleren står stille – og falder måleren tilbage til niveauet efter hostet, så er dette det rigtige tryk.
POCUS
Et nyere og lovende område for trykmåling, er oftalmologisk POCUS, hvor man måler dilatering af nervus opticus. Vi venter dog fortsat på flere studier før dette regelmæssigt kan anvendes
Svimmelhed
Se min blog om emnet

Putting it all together
Case: Din patient er en 39 årig kvinde, der præsenterer med snigende debut af følelsesudfald i højre side. Det startede over 5 minutter, og fortsatte distalt-> proximalt på armen og benene til maximal effekt ved 15 minutter. Symptomerne begyndte at gå væk igen efter 45 minutter. Patienten har aldrig oplevet det før, og føler sig nu meget bange for om det kan være TIA eller stroke. I akutmodtagelsen føler hun at hendes venstre ben nu også begynder at føles mærkeligt – dette er mere en prikkende og stikkende fornemmelse.
Anvend overstående metode til at argumentere for hvad der skal gøres – hvad gør du?
Kort svar:
Patienten har en præ-test sandsynlighed der er lav for stroke pga demografi. Vi kan spørge hende om risikofaktorer for at reducere dette yderligere, men ABCD2 scoren er formentlig ikke særlig meget værd – ligesom risikofaktorer generelte indenfor akutmedicin er dårlige prædiktorer for sygdom (st emlyns: Do risk factors factor in the ED?)
Where is the lesion (central, perifær eller funktionel / medicinsk?): Vi tænker overstående tegning igennem. Patientens læsion kan hypotetisk sidde i venstre hemisfære – der har ikke været nogen kortikale symptomer. Skal vi have hele billedet til at passe (med bilateral benpåvirkning), kunne man tænke på perifære neverskader (fx mononeuritis multiplex). Umiddelbart er vi dog ude i nogle sjældenheder, hvis hele billedet skal passe på én læsion – om noget sted, så centralt (dog atypisk at venstre ben er med, og højre ansigt ikke er)
What is the lesion: Patienten beskriver højresidige negativ symptomer (quality), som udvikler sig langsomt (timing) og ikke hele siden på én gang (onset).
Inden vores objektiv undersøgelse har vi følgende differentialdiagnoser:
- MS: lav sandsynlighed ud fra beskrivelse og det, at andre diagnoser er mere sandsynlige (migræne, funktionel – jf ruling out by ruling in) – alderen taler for – og alle neurologiske symptomer kan potentielt være MS (den evige differentialdiagnose)
- Stroke / TIA: Mindre sandsynligt – negativ og positiv symptomer, lokalisation kan være central – men atypiske elementer, onset og timing passer ikke med CVL (cerebrovaskulær læsion). Bilaterale læsioner taler imod.
- Migræne: Mere sandsynligt – negative og positive symptomer, alder passer, aura skal være <60 minutter pr aurafænomen
- Fokal epilepsi: Muligt, men mindre sandsynligt ud fra alder. Man kan forsøge at øge sandsynligheden ved at spørge til familie historie
- Funktionel / somatiserende: Mest sandsynlig sammen med migræne. Atypiske ikke neuro-anatomiske tegn. Muligt venstresidige bensymptom er pga hyper-awareness efter første højresidige fænomen
- Perifær skade: Mindre sandsynligt pga asymmetri. Mononeuritis multiplex kommer og går ikke, og er desuden yderst sjælden.
Hvilke 3 undersøgelser, vil du udføre, for at komme diagnosen nærmere?
I dette tilfælde, kan jeg ikke sige, der er nogen særlig undersøgelse jeg vil lave fremfor andre (sensoriske symptomer = lavt hieraki, atypisk distribution og ingen af overstående differentialdiagnoser vil have særlige tegn på undersøgelsen). Det bliver derfor en screeningsundersøgelse med neurologi (jf herover).
Neurologisk undersøgelse er uden positive fund – findes der parakliniske undersøgelser på akutmodtagelsen, der kan få os nærmere?
Umiddelbart nej – ingen blodprøver / EKG undersøgelse vil ændre noget. Vi har ingen mistanke om medicinsk årsag, og finder vi en positiv test vil det være svært at fortolke den (endsige relatere den til symptomerne). CT vil ofte blive gjort på denne kvinde, men sandsynligheden for at finde noget er lav (Do et al, 2018), og det vil være “et skud i tågen” med risiko for falsk positive og incidentalomer.
Hvad vil du fortælle patienten?
Symptomerne er med størst sandsynlighed pga migræne-aura ud fra din alder og symptomerne – Symptomerne du har haft har været ekstremt ubehaglige (validering), og det vil ikke være unormalt (normalisering), hvis du begynder at blive mere kropsbevidst efter en sådan episode (funktionelle / somatisering spektret). Desuden kan mange efter aura-fænomener blive trætte og føle sig anderledes tilpas. Sandsynligheden for alvorlig årsag til dine symptomer er ekstrem lav, og vi vil være trygge med at sende dig hjem
Hvad skal patienten være opmærksom på?
Dette var førstegangs anfald. Såfremt patienten får episoder der varer >60 minutter, eller har motoriske udfald / synsudfald, skal hun søge læge. Det betyder ikke, at det er farligt, men at man blot skal undersøge og revurdere.
En normal årsag til sådanne symptomer kan være stress-relaterede (The how), og taler man i generelle termer, kan dette være kropslige symptomer på fx homeostaseproblemer (mad, søvn, motion). Desuden kan migrænetærsklen ændres ved dårlig homeostase / stress, således at man får flere anfald.
Migræne med aura diagnosen kan ikke stilles, da man skal have 5 anfald.
Skulle man tænke TIA på dette, skal patienten behandles livslangt med ASA – behandlingstærsklen er med andre ord ekstrem lav for TIA, og der kræves mere tydelige symptomer før man kommer over tærsklen for indeliggende udredning
Ekstra om TIA/amaurosis fugax og stroke
Det beskrives ofte klassiskt (EMU 365: Everything you need to know about TIA in 10 min) at strokes / TIA præsenterer med
- Hyperakutte symptomer (udvikler sig over sekunder)
- Alting på én gang med blivende symptomer (hele arm / ben på én gang)
- Neuroanatomisk distribueret
- Oftest negative symptomer > postive symptomer
Og overstående vurdering skelner det fra fx epilepsi eller migræne. Oversstende er virkelig gode tommelfingeregler at tænke på, og også dem, jeg anvender. Virkeligheden er dog ikke altid som tommelfingerregler angiver:
- Hyperakutte symptomer, fx ved synsfænomener, kan være “pludseligt oplevet” eller “pludseligt opdaget” (du ved ikke du er blind, før du kommer i en situation, hvor det er tydeligt)
- Alting på en gang: Thalamiske strokes, kan have en “waxing and waining” symptomdebut, TIA kan være “stuttering” og have symptomer der kommer og går
- Neuroanatomisk distribueret: Hvis man læser fx Stone og Hallet og deres øvrige artikler, ved man, at der til hver af de funktionelle tegn og anamnestiske elementer, findes en LR tilknyttet. Funktionelle Neurologiske symptomer dannes ud fra patientens underbevidste forestilling om hvordan nervesystemet ser ud og fungerer. Er din patient en neurolog, bliver det nok sværere
- Negative symptomer > positive symptomer: Strokes / TIA kan have positive symptomer. Et eksempel kan være Hemibalisme ved strokes, eller amaurosis fugax med positive symptomer (jf uptodate).
Så kan vi overhoved ikke bruge anamnesen!? Jo, selvfølgelig kan du det. Overstående mod-eksempler hører til sjældenheder. Det er blot for at illustrere, det probabilistiske i diagnostikken. Uden at have studier til at bakke dette op, så er det logisk, at hyperakut opståede neuroanatomisk distribuerede symptomer som kommer på én gang og er negative, har en høj LR – særligt hvis din objektive undersøgelse stemmer overens med det. Men har du hyperakut indsættende POSITIVE symptomer (fx lysglimt imod bilaterale venstre synsfelter) på en 70 årig storryger, så vil jeg IKKE turde udelukke stroke (eller andre neurologiske tilstande som tumor eller epilepsi) bare fordi symptomer er positivt.
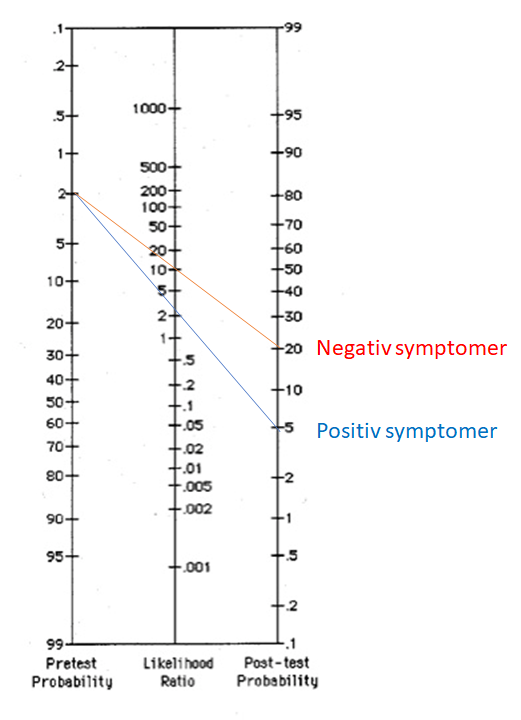
Man kan argumentere for, at i visse patienter (yngre), vil positiv symptomer endda sænke risikoen (altså negativ LR) for TIA
Desuden handler det om “nuancen” i beskrivelsen af symptomerne. Et “negativt symptom” kan være mange ting (lidt nedsat følelse eller total bedøvelse)
Igen er anamnesen og gode kliniske kommunikationsegenskaber uvurderlige i bedømningen
Ovenpå dette, så har Canadas neurologiske forening i 2018 (Lin et al, 2018: A summary of the Canadian Stroke BestPractice Recommendations,Sixth Edition (2018):Updates relevant to prehospital and emergencymedicine providers) udgivet anbefalinger der implicerer og understøtter et hieraki af symptomer (jf gennemgang af subjektive vs objektive symptomer under neurologisk undersøgelse).

Trombolyse af stroke patienter
Det er ingen hemmelighed, at tPA til stroke patienter er kontroversielt, og at litteraturen er gennemgået i detaljer gennem de seneste år. Jeg har ikke tænkt mig, at gå i detaljer om diskussionen, men henviser til
- EmCases: https://emergencymedicinecases.com/thrombolysis-endovascular-therapy-for-stroke/
- LITFL: https://litfl.com/the-use-of-thrombolysis-as-a-treatment-for-acute-stroke/
- LITFL: https://litfl.com/why-we-should-be-very-wary-of-using-clotbusting-drugs-to-treat-acute-strokes/
- First10Em: https://first10em.com/thrombolytics-for-stoke/
- TheNNT.com: https://www.thennt.com/nnt/thrombolytics-for-stroke/ (som nyligt blev ændret til https://www.thennt.com/nnt/thrombolytics-acute-ischemic-stroke/)
- Peter Appelros, 2017: Nytt beslutsstöd väcker frågor gällande intravenös trombolys
Kort sagt, så er debatten kompleks og handler både om
- Farmakologiske firmaers manipulation af studierne ,
- Neurologernes kliniske erfaring med at det virker (selvom modargumentet er, at trombolyse der virker indenfor 24 timer, er en mimick – jf “regression to the mean” og First10Em i kilderne herover)
- Akutmedicineres skepsis overfor litteraturen (hvis vi anvender samme kritik som ved alle andre behandlinger vi anvender)
Jeg har ingen løsning på problemet, men jeg tror jeg har opnået en slags forståelse af, hvorfor vi kan være så uenige om samme studier.
For at forklare det, må jeg vise EBM modellen:
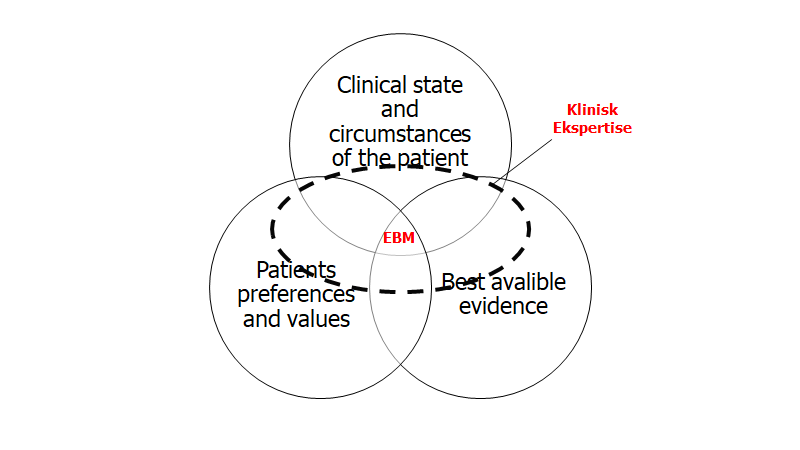
Haynes forklarer:
“Initially, evidence based medicine focused mainly on determining the best research evidence relevant to a clinical problemor decision and applying that evidence to resolve the issue. This early formulation de-emphasised traditional determinants of clinical decisions, including physiological rationale and individual clinical experience. Subsequent versions of evidence based decision making have emphasised that research evidence alone is not an adequate guide to action. Rather, clinicians must apply their expertise to assess the patient’s problem and must also incorporate the research evidence and the patient’s preferences or values before making a management recommendation “
Og fortsætter
“Clinical expertise must encompass and balance the patient’s clinical state and circumstances, relevant research evidence, and the patient’s preferences and actions if a successful and satisfying result is to occur
[…]
Clinicians must be atop not only the research evidence, but they must also acquire and hone the skills needed to both interpret the evidence and apply it appropriately to the circumstances — doing the right things. Finally, although communication with patients has always been important, determining the role in decision making that patients desire, ascertaining their preferences, and providing patients with the information they need to make an informed choice has never been more challenging.
[…]
determining what the patient wants and factoring this into the decision process is a growing responsibility of clinical expertise, currently limited by our understanding of how to determine patients’ preferences.
For detaljer for denne essentielle figur, se EmCases Ep 47 podcast og First10Em: Evidence based medicine is still the best kind of medicine og Hayes, 2002: Clinical expertise in the era of evidencebased medicine and patient choice
Ud fra overstående model er det evident, at klinisk evidens ikke er NOK til at træffe en beslutning. Patientens values er også enormt vigtige. Vi kan forestille os, at der findes forskellige tærksler, for behandling, alt efter hvilket perspektiv vi anvender
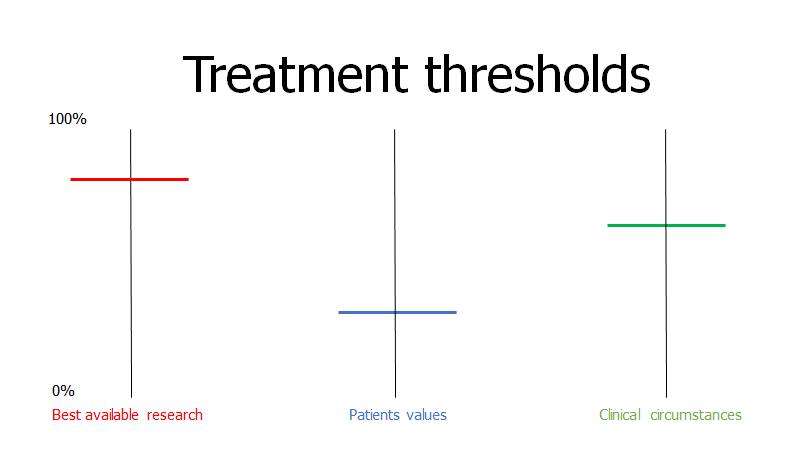
Tager vi fx tPA behandling af stroke patienter:
Fra perspektivet af best avaiable research: Forholdsvist kontroversiel evidens for tPA anvendelse ved iskæmiske strokes, særligt ved NIHSS <5 (jf PRISM studiet). Det outcome man i bedste fald får ud fra NINDS-2 studiet, er en reduktion i mRS score (variabel evidens på hvor meget), men det er usikkert hvilke af vores patienter der har denne benefit. Ifølge theNNT.com er NNT 10, 19 og 50 v. hhv <3, 4,5 og <6 timer, imens tilsvarende NNH for signifikante blødninger er mellem 40-50 (og større ved mimicks – dvs færre blødninger)
Fra perspektivet af “patients values”: It depends – det kan være svært i situationen at få information fra patienten om, hvad der er vigtigt for patienten. Og at have denne samtale i kritiske situationer er etisk kontroversielt, og praktisk ofte problematisk (særligt, hvis man har afasi). Derfor må vi ofte anvende pårørende – men kun som advokater / støtter. Det er i sidste ende en lægebeslutning, da det ikke er pårørende som skal gives byrden af beslutningsansvaret. For en dybere gennemgang af dette, anbefales fx Atul Gawandes 5 spørgsmål i being mortal (http://www.triadhealthcarenetwork.com/wp-content/uploads/2016/07/Atul-Gawandes-5-questions.pdf ). Men det kan være, at patientens values er, at de absolut under ingen omstændigheder vil være “grøntsager”. Et problem ved “mig lige nu” beslutninger versus “mig om 6 måneder”, er at ofte lærer man at adaptere sig og blive lykkelig med den nye tilstand (jf studier på folk med traumatiske cervikale medullære læsioner).
Fra perspektivet af “clinical circumstances”: Så studiet siger, at man skal kunne give trombolyse indenfor 4,5 timer, men vi er nu på 4 timer og 15 min med en NIHSS på 3. Eller måske skal patienten transporteres 2 timer for at kunne få trombolyse. CT skanningen er gået ned i dag, eller der er ikke mere tPA på lager. Vores erfaring er måske, at denne slags patienter ikke klarer sig så godt (klinisk erfaring, recency bias m.m)
Den kliniske situation er både lokale muligheder og ressorucer, som den kliniske case som patienten er.
Samlet set, er alt dette klinisk ekspertise, og om vi skal gøre det (i eksemplet – behandle med tPA) eller ikke, afhænger altså af kombinationen af alle tre i den VIRKELIGE VERDEN på DIT HOSPITAL og på DIN AFDELING
For detaljer, hør podcasten fra EMCases Ep 47
Billedekilde: egen produktion
Så det kommer ned til
- Patientens ønske: som ofte er at “gøre alt”, hvad vi kan for at forhindre manifest stroke – dog kan man argumentere, at symptomerne skal være invaliderende (som mange trombolyse-neurologer også gør). Dette bliver særligt delikat ved NIHSS <5 jf Kathri et al, 2018: Effect of Alteplase vs Aspirin on Functional Outcome for Patients With Acute Ischemic Stroke and Minor Nondisabling Neurologic Deficits
- Kliniske muligheder på din afdeling: har du et hospital med en kort door-to-needle time, og en struktur der er gearet for håndteringen af trombolyse-patienten, så er det et betydeligt plus. Har du ikke det, så har du ret til skepsis ift hvad der er muligt dér hvor du arbejder
- Evidensen (jf herover)
Det jeg vil afslutte med, er blot problemet med “indication creep”, som er den slippery slope trombolyse er på, når vi udvider kriterier udover, hvad der findes evidens for

Der er en hårfin balance mellem at anvende svagere evidens med hensyntagen til “patients values”. Det kan være en slippery sloap, og hvornår det er okay at fx trombolysere pga alene impressiv afasi som er i overenstemmelse med patient values, og trombolysere efter 6- og 12 timer på samme indikation, er i klinisk praksis ofte svært at sætte. Risikoen er, at patienten får alle bivirkninger uden effekt, jo længere vi bevæger os udenfor en evidens-baseret terapi’s originale indikation
“Indication creep occurs when an intervention program to benefit patients with a specific health condition is either expanded to a broader patient population or expanded to a different health condition” Riggs et al
Dette ses fx når man på videre og videre indikation behandler med tPA, trods mangelfuld evidens.
Som beskrevet herover, så kan dette ud fra en EBM tankegang, nogle gange retfærdiggøres, hvis patientens values er meget stærke, og kan veje tungere end evt vag evidens (jf herover om EBM modellen). Det er dog en slippery sloap, og hvornår man skal stoppe, er ikke vel-defineret – hvilket ofte udnyttes af firmaerne bag de enkelte stoffer (off label indikationer).
Risikoen ved dette er tydelig: “As interventions creep into new populations or different diseases, they typically do so in ways that lower the potential benefit: milder disease, which is less likely to cause problems, or sicker patients, who have higher competing risks of having problems regardless of whether they receive the intervention. Despitethe lower potential benefit, the risks of the intervention wil ltypically be the same or higher. This systematically pushes the balance away from aggregate health benefit towards harm” (Riggs et al)
Eller som Justin Morgenstern rammende beskriver i EmCases Ep 126:
“Harms are static, benefits are variable”
Et eksempel kan være at der findes nogen evidens for prednisolon i særlige grupper med sepsis. Ekstrapolerer vi denne svage evidens til også at være “alle med sepsis skal behandles med prednisolon”, og siden til “alle med infektion skal behandles med prednisolon”, er effekten, at de får alle bivirkningerne, men formentlig marginal / ingen effekt. Dette er problemet med indication creep.
For detaljer, se Riggs et al, 2016: The Role of Professional Societies in Limiting Indication Creep og EmCases Ep 126 (første 30 min)