I del 1a opsatte vi en kæde af “medical misinformation mess” fra research -> guidelines -> patienten. Vi gennemgik i del 1a research-delen. Vi går nu længere ned downstream i kæden og taler om guidelines og lægen- og patienten.
Igen er dette et “pluk” af nogle af mine hovedpointer på området, og for en dybere gennemgang henviser jeg til litteratur-bibiloteket i starten af del 1a
3. Guidelines
Er guidelines et godt koncept?
Most guidelines have become a marketing tool and have even become a thread to patients
John P. Ioannidis 2019, ScanFOAM Reducing waste in health care research
Too often supervisors insist that workers follow some shallow rules that never were validated, some of which may be obsolete. Workers then face the dilemma of whether to do the job right or to stick to the procedures. If they use their judgement and then run into trouble they may be penalized for not following the guidelines. If they stick to the guidelines and run into trouble, they may be penalized for failing to get the job done. They lose either way
The fear of human error also influences health care. Some physicians are resisting the trend [of making choices based primarily on statistics]. They feel uncoformtable subordinating their judgement to statisticians. They are unwilling to make judgements that conflict with guidelines, for fear of being sued or even prosecuted if the patient shows adverse effects. They don’t want to subordinate their judgement to “best practices” that may not apply in specific instances
Gary Klein, Streetlights and Shadows
When we emphasize procedures over skills we set a standard of mediocre perfromance . The standard procedures become a basis for evaluating job performance, making people even less likely to adapt or improvise (expertise erosion) and more careful to comply with the rules
Procedures, checklists and decision aids are all designed to catch and correct possible mistakes. But eliminating mistakes isn’t the same as gaining expertise. One of the themes of this book is that a fear of mistakes should be balanced with a pursuit of expertise. I think most organizations overdo the human-as-hazard model and put too much effort into reducing or eliminating mistakes. I don’t think organizations do enough to help their workers become skilled. In many cases our aversion to mistakes may be counter-productive. We must make mistakes in order to learn. R. Buckminster Fuller once said “If I ran a school I’d give the average grade to the ones who gave me all the right answers, for being good parrots. I’d give the top grades to those who made a lot of mistakes and told me about them, and then told me what they learned from them”. When organizations crack down on mistakes, they may unwittingly slow the rate of learning. Employee evaluations usually highlight mistakes and failures because these are easier to spot and document. In the health care industry and in the aviation industry, prosecuteors sometimes press crimincal charges against people who make mistakes. Some people may get satisfaction from seeing nurses or pilots hit with fines or jail sentences. However (as Sidney Dekker has complained), these sanctions reduce safety rather than increasing it. We learn from mistakes by diagnosing why they happened, but if organizations is overzealous about reducing mistakes, then workers may spend more time covering up their mistakes than they spend trying to figure out what caused those mistakes and how to do a better job in the future
A wise person is made not born. Wisdom [talking about compassion , empathy and wisdom] depends on experience , and not just any experience: you need the time to get to know the people that you are serving. You need permission to try to improvise , to try new things , occasionally to fail and to learn from your failures . And you need to be mentored by wise teachers … without wisdom , brilliance isn’t enough . It is as likely to get you and other people into trouble as anything else
As we turn increasingly to rules [i.e when something bad happens and we want to avoid it from happening again ], rules and incentives may make things better in the short run , but they create a downward spiral, that makes them worse in the long run . Moral skill is chipped away by an over reliance on rules (and you don’t have to think as much) [red: erosion of expertise ] that deprives us from the opportunity to improvise and learn from our improvisations . And moral will is undermined by an incessant appeal to incentives that destroy our desire to do the right thing
[We do 2 things when problems occur : rules and incentives]:– 1: rules :… scrips [i.e rules and algorithms] are insurance policies against disaster . And they prevent disaster , but what they assure in its place is mediocrity. don’t get me wrong we need rules [just not so many that it kills wisdom, empathy , skill, flexibility, improvising and expertise]
– 2: incentives [red: fx 4 timers regler] : it seems only logical that two reasons are better than one and you seem more likely to do it – right ? Not always . Sometimes two reasons to do the same thing seems to competes with one another instead of complimenting and it makes people less likely to do it […] there are no incentives you can device that will ever be smart enough – any inventive system can be subverted by bad will[…] we need incentives[…] but excessive reliance on incentives demoralises professional activity (the person engaging in the activity looses moral and the activity itself looses morality )
Barry Schwartz, Our loss of wisdom (TED talk)
As heads of organizations we should strive to create environments that encourages and nurtures both moral skill and moral will. Even the wisest and most well meaning people will give up if they have to swim against the current in the organisations in which they work […] the truth is that any work you do that involves interacting with other people is moral work and any moral work depends on practical wisdom [moral skill and moral will]
For en dybere diskussion af guidelines, og deres fordele / ulemper anbefales fx
- Jerome Hoffman, youtube – clinical guidelines, be sceptical
- Jerome Hoffman, youtube – the challenge of physician variability
- Jerome Hoffman et al, overdiagnosis in medicine – a modern epidemic
- Jerome Hoffman et al, Intolerance of error and culture of blame drives medical excess
- Jeanne Lenzer, hoffman og ioannidis (link herover) om guidelines
- First10Em: Crappy guidelines, og why guidelines suck
- Gary Klein: Streetlights and Shadows (bog)
- Trisha Greenhalgh: CEBM – real and rubbish EBM (youtube)
- Kahneman og klein et al: Conditions for Intuitive Expertise A Failure to Disagree
Der var engang, hvor medicin ikke var mere kompliceret, end at lægen kunne have et overblik over sit fagområde ved at læse de videnskabelige artikler indenfor sit felt. Denne tid er for længe siden svundet, og i dag har lægen sjældent tid til at holde sig opdateret. Guideliens har været en løsning på dette, som et destilat af viden. Men vi ved alle, at information kan manipuleres når de kommer ned igennem filtrene, og er guidelines i dag virkelig deres vigtige ansvar (som primær kilde til viden for mange læger) modent?
Guidelines har i min mening teoretisk i dens optimale form, som en værktøjskasse til at hjælpe klinikeren der ud fra sin egen patient må forsøge at applicere rigtigt værtktøj og indenfor akutmedicin i en rækkefølge som er rationel til en specifikt scenarie – en god guideline er med andre ord gennemtænkt (ift billeder, sprog, design, anvendelse), og kontekst specifik. De større guidelines skal være som værktøjskasser, til klinikeren der ikke kan nå at læse op på alt altid: en samling af evidens, med tydelig angivelse af interessekonflikter, vægt af evidenssen, LR (likelihoodratio) / NNT (number needed to treat), IRR (interrater-reliability), info om hvilken population guidelinens forskning kommer fra (ambulatorie, hospital, akutmodtagelse, AP etc) og med inklusionskriterier for anvendelse af guidelinen, og hvilke outcomes det er målt på m.m) en vigtig plads i medicin.
Om guidelines som koncept / idé er god, afhænger af dit ekspertise niveau (Weingart) på et område:
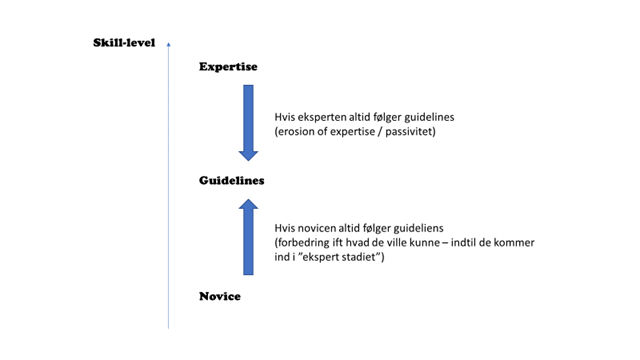
- Lægen som novice: Vi læger betragter os som eksperter i “medicin”, men efterhånden er mange af meget af medicin så hyperspecialiseret (hvilket i sig selv er et problem, fordi patienter ikke kommer i fine kasser – jo mindre generalister vi bliver, des mere afhængige bliver vi af at patienter sorteres rigtigt til at starte med. Er det virkelig det vi prioriterer lige nu? God sortering?), at ingen har overblik, og man konstant er bange for at gøre ting suboptimalt. Man second-guesser sig desuden ofte (imposter syndrome: er jeg god nok?). Guidelines sætter en slags “standard” for novicen så selv en med relativt dårligt kendskab til et område kan følge “cook book medicine”. På denne vis er guidelines idé ikke dårlig, til at reducere “innappropriate variability”
- Lægen som ekspert: Vi arbejder med komplekse situationer, og patienten er et individ (N of 1) og man kun i ringe grad applicere viden fra kohorte studier på individet. Lægen som ekspert indenfor et område vil ofte “fordummes” af at følge en guideline (kaldet “erosion of expertise”). Problemet set udefra er, at eksperten selvfølgelig også laver fejl. Eksperten er BEDRE end guidelinen og novicen, men ikke perfekt. Når eksperten laver fejl, kan man kun beskylde det på eksperten. Men uden rum til at udvikle os udover guidelinens simplistiske rammer, og bevæge os in i nuancerne og kompleksiteten, kommer vi aldrig være bedre end “adequate”.
Experts are operationally defined as those who have been recognized within their profession as having the necessary skills and abilities to perform at the highest level
Kahneman and Klein: Conditions for Intuitive Expertise A Failure to Disagree
A crucial conclusion emerges: Skilled intuitions will only develop in an environment of sufficient regularity, which provides valid cues to the situation.
[physicians] exhibited genuine expertise in some of theiractivities but not in others. We refer to such mixed grades for professionals as “fractionated expertise,”…
Mit første centrale problem med guidelines som idé, er derfor den moderne holdning til guidelines som “standard of care” (hvilket degraderer lægen som ekspert), hvilket implicerer, at der findes et “facit” til håndteringen af en klinisk problemstilling (hvilket jeg mener er en stor hubris i medicin, at vi tror, at der gør – og at det for den sags skyld kan standardiseres). Denne status som “standard of care” (eller noget der ligner) er med andre ord stærkt problematisk.
Jeg mener som sagt, at de fleste guidelines burde fungere som en værktøjskasse for lægen, som ud fra dem selv kan træffe beslutningerne om, hvorvidt det i den pågældende situation er en god idé at applicere dem. Gør vi ikke det, er vi i højere og højere grad tilbøjelige til at gøre det guidelinen siger i stdet for det, situationen påtvinger (særligt, hvis vi måles på, og straffes for, ikke at udføre det guidelinen sagde)
Det er vigtigt i denne forbindelse at forstå, at en specialist IKKE er det samme som en ekspert (du kan have et skilt, hvor der står fx “kardiolog”, men din H-læge kan være meget længere end dig på vejen til ekspertise indenfor et område). Vil du læse videre ind i, hvad en “ekspert” er, og hvad begrænsningerne er (hvornår ved vi, at vi er eksperter?), om dunning-kruger effekten m.m, kan følgende kilder anbefales
- Gary Klein og Daniel Kahneman: Conditions for Intuitive Expertise A Failure to Disagree
- Scott Weingart: https://emcrit.org/emcrit/how-not-to-be-a-resuswanker/
Lad os pakke nogle af argumenterne lidt ud:
1. Guidelines som “standard of care” – Variabilitet- og flexibilitet-problemet, og second victim: Formålet med guideliens er kort sagt, at fjerne “innapropriate variability“, og at hjælpe novicer på et område, at træffe bedre valg. Men kan vi stole på dem? Og er det virkelig sådan de anvendes i dag?
Meget af dette omhandler et større spørgmål (som jeg berørte kort i “intro”-delen), om “population”-behandling Vs “individ”-behandling (guidelines er jo i essensen generalisering fra studier til individet), og standardisering. Det store spørgsmål har her været, hvilken grad af variabilitet, der er acceptabel, for den praktiserende læge?
Det argument Dr Senthi sætter op (del 1a), er foruroligende, og plausibelt: Ikke nok med at det meste research er nytteløst, så er de studier vi troede, vi var i stand til at fortolke (særligt mhp bias, p-værdier og interessekonflikter), og som jo ligger til grundlag for majoriteten af de guidelines vi efterhånden ikke tør andet end af følge pga deres efterhånden opblæste status som “standard of care” måske fejlagtig.
Hér er den centrale styrke- og problem med guidelines: Vi vil gerne at læger tænker selv, men også at de ikke gør noget drastisk og dumt. For tiden er vi gået over i en tendens, hvor vi stoler så lidt på lægen (eller al behandling er blevet så hyper-specialiseret, at ingen har overblik), at vi hellere vil, at alt skal være en kogebog (hvilket, som jeg tidligere har argumenteret, går dårligt i komplekse problemstillinger). Måske vi bare burde have guidelines i Iona Heaths ånd?
..I want a doctor who is prepared to think. I long for the day, when NICE stops producing guidelines and simply gives us summaries of the evidence instead , with clear indication of the limitations of their evidence and the extend of uncertainty, and always acknowledging the possibility of harm. So that NICE too, encourages clinicians to think instead of telling them what to do
Iona heath, Iona Heath – Eminence or evidence-based medicine: why this question is still relevant today (youtube, CEBM)
Jeg tror et af de centrale problemer er hyperspecialiseringen (folk kender ikke detaljer om alt længere – og detaljerne beskrives i guidelines som at de betyder meget…noget jeg er skeptisk over jf diskussion herunder), det tiltagende krav om “sikkerhed”, og manglende forståelse for “usikkerheden” i medicin m.m
Generelt tror jeg fortsat at en god portion variation er nødvendig, delvist fordi, hvis vi skal skræddersy behandling til patienten, kan vi ikke køre efter populationsbestemte guidelines (i.e if you want individualized medicine, you must expect some variability). Vi fanges desværre ofte i klemme, når guideliens betragtes som “reglen”
Jeg har skrevet flere blogs om dette koncept, og anbefaler for dybere diskussion denne blog: https://akutmedicineren.dk/best-of-akutmedicineren-2020-del-3-den-usynlige-patienrisiko-regression-to-the-mean-og-overdiagnostik/ og denne blog: https://akutmedicineren.dk/erfaringer-fra-stockholm-fejlkultur-og-resuswankers/
2. Opportunity cost-problemet: Opportunity Cost (prisen ved at vælge A i stedet for B) – Dette koncept har jeg tidligere beskrevet, og er kort sagt, den “harm” der er ved at vælge en ting i stedet for noget andet. Det kan virke banalt, og umuligt at slippe væk fra – og det er det også til dels.
Jeg kan dog blive enormt frustreret, når guidelines lister 10 ting man SKAL gøre, men ikke formår at beskrive hvilken som virker bedst i given situation, og hvilken population, IRR, LR / NNT:NNH der findes. Når man som akutmediciner har 5 min til at anvende 3 af de ting på listen, så vil du anvende det med højest NNT. At anvende for meget tid på at give en som har minimal harms og effekt er måske i sig selv ikke harmful, men er harmfull fordi du kunne have anvendt tiden på noget andet! Dette koncept er essentielt, og gennemgående i de fleste guidelines jeg kender (se Jeanne Lenzers link herover om guidelines for flere detaljer).
3. Erosion of expertise: Guidelines anvendes bl.a også fordi det er “lettere” at lade et stykke papir træffe de tunge beslutninger (“du skal have behandling A, fordi du er i denne kategori – hvis du ikke er enig, så er det imod lægens råd”). At træffe de tunge beslutninger, kræver hele essensen af lægekunstskab, og når vi i højere og højere grad går væk fra at “tænke selv”, fører det til en sløvning- og forfald af vores individuelle ekspertise, men også kollektive ekspertise som fagområde (hvem skal til sidst lære os “bedside” ekspertise?).
Professor i almen medicin, Trisha Greenhalgh, har beskriver problemet når guidelines appliceres uden omtanke for patienten som individ, og der ikke findes “applikations kriterier” for guidelinen (CEBM youtube)
Lidt som Gary Klein (Streetlights and shadows, psykolog), og Pat Croskerry (Akutmedicinsk professor med speciale i decision-making, og bl.a forfatter til Diagnosis – Interpreting the shadows) forklarer Trisha, at vi bevæger os i skygger (komplekse og inherente usikre situationer). En guideline er en lyskegle (en forsimpling, hvor vi kan se vejen). Alt for ofte tør vi ikke være eksperter og finde vej igennem skyggerne med vores patienter ved aktivt at lytte til patienten, og bedrive holistisk medicin. Alternativet bliver ofte, at man presser patienten ind i den guideline som passer bedst: Vi kigger efter nøglerne under lampen – ikke fordi vi tror de ligger der, men fordi det er det sted, vi sikkert kan se. Jeg vil Professor Greenhalgh og Professor Klein forklare resten
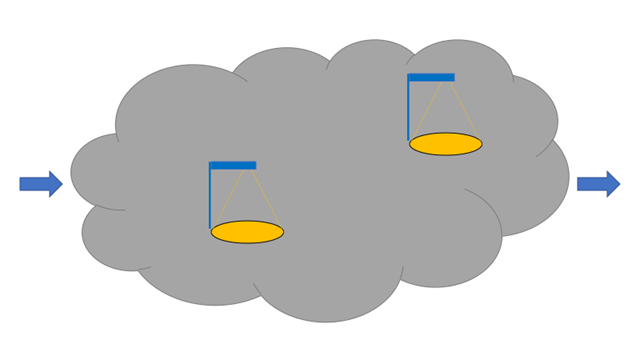
Figuren har jeg anvendt før, og kommer egentlig fra konceptet i Streetlights and shadows af Gary Klein, hvor “skyen” repræsenterer “komplekse problemer” (som ikke KAN sættes på algortime / guideline). Visse elementer af de komplekse problemer, er “gadelygter”, hvor man har en sikkerhed i hvordan man skal gøre (i.e guidelines).
We should avoid using evidence‐based guidelines in the manner of the fabled drunkard who searched under the lamp post for his key because that was where the light was, even though he knew he had lost his key somewhere else (quoting sir John Grimley Evans)
My individual case narrative (deliberately chosen for being atypical, thereby highlighting the difference between individual evidence and population‐derived evidence) adds to a growing literature on the overuse, underuse, and misuse of clinical guidelines. The existence of many thousands of evidence‐based guidelines is no guarantee that the right section of the right guideline will be applied to the right patient at the right time. On the contrary, the accumulation of unmanageable numbers of lengthy guidelines makes it ever more likely that the clinician at the front line will manage his or her patients using early categorization, frugal heuristics, and a privileging of operational rationality over case‐based moral reasoning
It takes judgement to know which guideline to follow, and how to follow it
Trisha Greenhalgh, Of lamp posts, keys, and fabled drunkards: A perspectival tale of 4 guidelines, og CEBM youtube (rubbish EBM)
Procedures are most useful in well-ordered situations [streetlights] when they can substitute for skill, not augment it. In complex situations – in the shadows – procedures are less likely to substitute for expertise and may even stifle its development
Gary Klein, Streetlights and shadows
Too often supervisors insist that workers follow some shallow rules that never were validated, some of which may be obsolete. Workers then face the dilemma of whether to do the job right or to stick to the procedures. If they use their judgement and then run into trouble they may be penalized for not following the guidelines. If they stick to the guidelines and run into trouble, they may be penalized for failing to get the job done. They lose either way
Mit andet centrale problem med guidelines, er måden de udformes på, og vores naivitet omkring interessekonflikter (særligt når vi, som jeg i del 1a har argumenteret for, ved at den forskning guidelines bygger altid vil være mangelful- og biased)
Udformningen af guidelines – Er de til skade eller gavn?
Måden hvorpå guideliens udformes er langt fra idealet. Der ligger en absurd ironi i dette – hvis vi skal følge guidelines, hvorfor skal guidelines folket så ikke gøre det, når de udformes? (her tænker jeg særligt på anvendelse af folk på centrale poster med interessekonflikter etc)
Problemerne med udformningen er mangfoldige fx:
- De har (ofte skjulte) interessekonflikter fra dem der udformer dem og organisationerne der “ejer” (påberåber?) sig at lave dem
- Der mangler ofte koordination guidelines imellem (skal jeg følge hypertensionguidelinen eller diabetesguidelinen?)
- Manglende “inklusions”-kriterier for guidelinen (ofte er guidelines et uforståelig konglumerat af forskellige patientpopulationer i forskellige settings – med andre ord en slags meta-analyse oftest uden en systematisk tilgang. Den eksterne generaliserbarhed er ofte ringe, og testes desværre sjældent i studier. Særligt i akutmedicin og i almen medicin kan det være frustrerende hvis guidelines laves af hospitals-læger på specialiserede centre, der ser en meget snæver høj-risiko population: skal dette appliceres til lav-risiko også?)
- Ikke altid referencer i guidelines
- Skaber en “pseudosikkerhed”, på områder hvor “ambiguity” ofte er bedre
Justin Morgenstern har nyligt lavet en oversigt over hvad gode guidelines indeholder
- A clear distinction between recommendations with strong evidence and those without.
- A discussion of harms alongside benefits.
- The use of absolute numbers or NNTs and the inclusion of confidence intervals.
- Clear references to the underlying science.
- Clear statements of uncertainty when it is present.
- A mechanism for feedback from all important stakeholders.
- The ability to update rapidly when new evidence arises.
- Inclusion of any dissenting opinions, if they exist.
- When a topic is known to be controversial, guidelines should actively seek involvement from authors on every side of the debate.
- The exclusion of authors with conflicts of interest and a clear discussion of how the panel of authors was selected. Authors should include both content experts and science or methodology experts, with the science experts taking the lead.
- If possible, reference to and discussion of any conflicting guidelines.
Er det guidelines som driver overdiagnostik?
When talking about tests and treatments: it’s not “risks and benefits”, it must either be “benefit and harm”, or “chance of benefit and risk of harm”. We either need to talk about both in “absolutes” or in “relatives”
Jerome Hoffman (Paraphasing)
Lad os lige få en ting på det rene, inden jeg fortsætter: Der er stadig masser af medicin, der virker – afskriv ikke farma-medicin eller guidelines som koncept! Det medicinske mirakel (som man ofte kalder al den gode teknologiske medicinske viden- og afkast, der kom i guldalderen af medicin gennem 2. halvdel af 1900-tallet) skal ikke underkendes. Men vores desperation til at udbrede det medicinske mirakel til alle afkroge af medicin, og ridde på den bølge lidt endnu, har ledt til en enorm hubris (både indenfor medicin, men også for folkets syn på medicin som fag) som nu har gjort medicin teknologi-fixeret, og over-prioriteret ift mange andre relevante felter (fx sociologi, psykologi etc) i sundheds-landskabet.
Det jeg siger er blot, at vores overmodige holdning til, hvor meget medicin der virker, og i hvor stor grad de virker, formentlig kraftigt modificeres. Ikke alene det, så afhænger det også i hvilken gruppe vi anvender medicinen (mildt syg Vs svært syg). Samtidig må vi i højere grad sige, at der altid er harms ved en medicinering (NNT og NNH). Måden sproget fungerer på i medicin er dog ofte, at “der er fordele og RISIKO for harms”. “Fordele” bliver her nævnt som et absolut, imens harms bliver nævnt som en relativ. Det burde være Harms og benefits, og vi bør på alle nivaeuer fra forskning til klinikken blive bedre til at forklare om begge sider af sagen til hhv asymptomatiske- og sympomatiske individer af enten lav-, moderat-, eller høj risiko. For informationen skal være helt forskellig!
Lad os kigge på nogle af ingredienserne i guidelines – definitioner-, diagnostik- og behandlinger:
1.Hvornår implementerer vi en ny behandling? Hvor meget evidens skal der til?
Et af problemerne med moderne medicin, er for tidlig implementering (se herunder om medical reversal). Anand Senthi har lavet denne fantastisk graf om, hvornår vi burde implementere en ny behandling (og som Ben Goldacre argumenterer, selvfølgelig altid følge op på bivirkniger, da nye behandlinger altid vi være højere risiko simpelthen fordi mængden af folk, der har fået den, er så lav, så mange bivirkninger kender vi endnu ikke til)
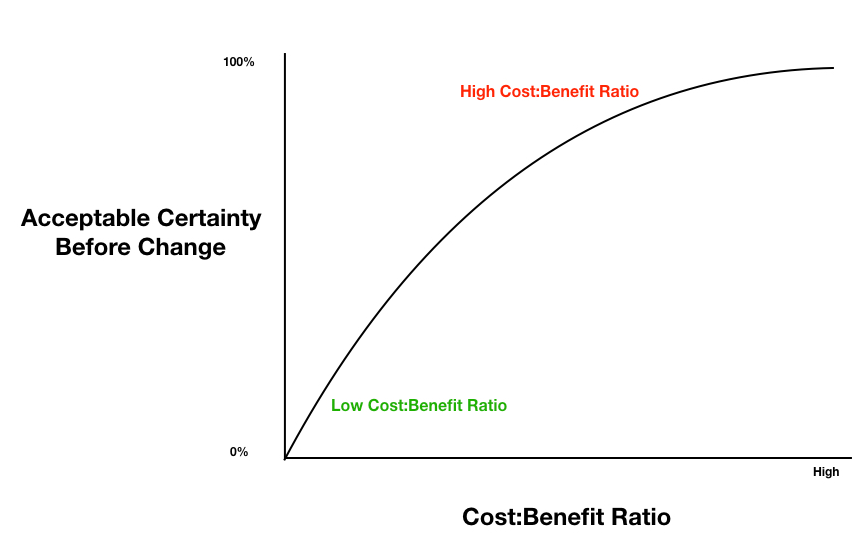
Den svarer desuden på det nogen kritikere af FOAM og EBM har postuleret: på den ene side, vil vi ikke, at behandlinger implementeres for hurtigt (= høj risiko for Medical Reversal), og på den anden side, vil vi gerne, at 17-års gappet mellem (God!) evidens og klinik bliver mindre. Det handler helt enkelt om kvaliteten af den evidens, præ-test sandsynligheden for at den virker, og hvilken skade den vil kunne gøre Vs benefit. Eksemplet med god evidens vs dårlig evidens, og implemetering: Dexamethason (risiko for skade er kendt, sandsynlighed for benefit høj efter RECOVERY studiet af relativ høj kvalitet) ved C19 Vs Remdesivir (dårlig evidens, risiko for skade – burde ikke være så tidligt implementeret)
Har du en billig ny behandling, som har været anvendt længe, med god benefit : cost / harm ratio (cost = penge, liv, ressourcer, opportunity cost etc), så behøver vi ikke særlig stor sikkerhed før den skal implementeres (Tag fx Dexamethason ved COVID19). Har vi derimod en bivirkningstung og dyr medicin marginale fordele, så kræves stor bevisbyrde for at implementere den (Fx Remdisivir for COVID19). Det er logiskt!
Problemet er dog, at pga interessekonflikter, og det pres farma-industrien har for at sælge, er det sjældent i den “grønne” del af graften vi befinder os, men snarere i den røde del, når nye stoffer / devices kommer på markedet. De nye stoffer er ofte dyre, og med dårlig evidens opbakning, som ofte er p-hacked eller lignende. Udover “marketing” (lobbyisme fx køb af FDA, patienforeninger, drug-reps etc) så findes der en lang række andre metoder, som anvendes af industrien. Et af dem, er at “købe” key-oppinon leaders som ofte sidder på guideline-panel. Ofte behøver de ikke engang købes, hvis de tilfældigvis er enige med at stoffet der sælges er godt.
2. Definitioner- og extrapolering fra andre settings:
Et særigt skadeligt koncept, som anvendes for at sælge mere medicin, er at udvide definitionen for “normal” Vs “ikke normal” (se fx Saving normal af allen francis). Et koncept kaldet Indication Creep:

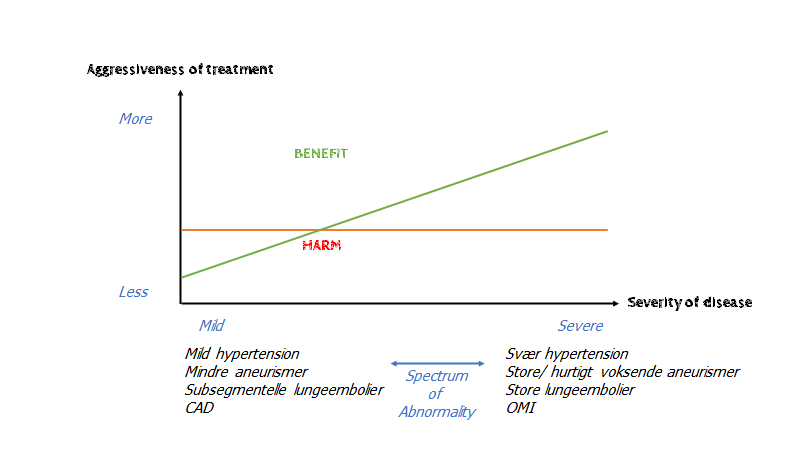
The rationale behind making more diagnosis works something like this: First, medical science identifies that some intervention improves an important health outcome in a high-risk group. Then someone makes the following supposision: “What’s good for a group on the severe side of the spectrum of abnormality, is probably good for a group on the mild side of the spectrum of abnormality”
The problem with extrapolating from severe to mild abnormalities [Creep] is that practically speaking, it is often not known wheter the same important benefits {POO – patient oriented outcomes som skaber POEM: Patient oriented evidence that matters] of treatment will apper in people with mild abnormalities…These events [i.e POO: death, invalidity etc]are so rare in those with mild abnormalities that it would take enormous studies to learn if treatment actually has an important benefit for this group. The studies required may need to be larger than any we could reasonably expect to conduct, So investigators focus on less important but more measurable outcomes as surrogates [i.e DOO – Disease oriented outcomed, MOO – monitor oriented outcomes fx forbedring af vitalparametre, LOO – Lab oriented outcomes fx forbedring af kolesterol]Gilbert Welch et al: Overdiagnosed
Indication creep occurs when an intervention program to benefit patients with a specific health condition is either expanded to a broader patient population or expanded to a different health condition. As an example of population expansion, consider a new medication that is proven to benefit a relatively young and healthy population, but is then used in practice on patients who are older and have comorbid conditions.
Riggs et al, 2014: The Role of Professional Societies in Limiting Indication Creep
Indication creep can harm individual patients. As interventions creep into new populations or different diseases, they typically do so in ways that lower the potential benefit: milder disease, which is less likely to cause problems, or sicker patients, who have higher competing risks of having problems regardless of whether they receive the intervention. Despite the lower potential benefit, the risks of the intervention will typically be the same or higher. This systematically pushes the balance away from aggregate health benefit towards harm
Dette kan grafisk bedst fremstilles således (figur 1 er introduktion, figur 2 er den grafiske fremstilling af creep)
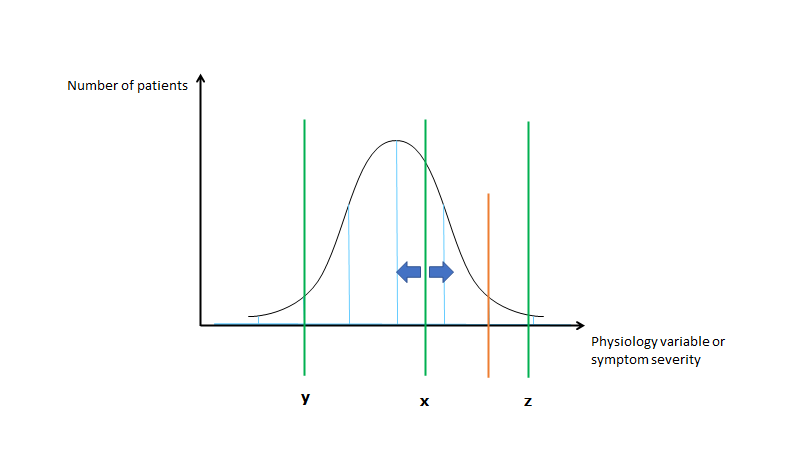
Man kan fødes på forskellig side af “sygdomslinjen” (hhv x, y og z). Nogle fødes med tydelig fænotypisk patologi (fx skizofreni i barndommen) – punkt Z. Alt efter “miljø’et” (dvs både positivt fx kærlig opvækst, motion, kost, rigtig medicinering og negativt fx misbrug, vold, dårlige coping strategier etc) , kan man bevæge sig ift sin genetiske disposition (tættere på, eller længere væk fra “sygdomsgrænse”). De fleste fødes til venstre fra sygdomslinjen (x og y), og nogle er så langt fra linjen, at der skal extrem miljøpåvirkning til før man kommer over sygdomsgrænsen (z), imens andre er tættere på, og med ufordelagtig miljøpåvirkning vil de kunne blive syge (x). Tænk fx hvis x og y begge begyndte at ryge (alt andet antaget at være lige), og sygdomslinjen var KOL. Så ville y ikke udvikle det, men x ville.
Indikations-creep og udvidelse af definitioner kommer i to former
- 1: Mere sensitiv teknologi (En analogi til dette er fremsat i “overdiagnosed” bogen – hvor mange øer findes der rundt om storbritannien? Bruger du en landkort vil du kunne regne dig frem til et tal. Bruger du google earth endnu flere, og man kan forestille sig, at der i fremtiden kan komme teknologi, der vil kunne finde endnu flere. Jerome Hoffman nævner en lignende analogi om lungeemboli: Hvis den CT vi har i dag er et mikroskop, hvad så om nogle år, når vi har et elektronmikroskop? Vi vil blive tvunget til, med bedre og bedre teknologi, at finde mere “abnormaliteter”, og hvad harms Vs benefit er ved at finde og behandle de forskellige entiteter er mildt sagt ukendt. Dette er “screenings-problemet”, og den ukomfortable sandhed, at vi alle har masser af ting i kroppen på et givens tidspunkt der er græsende til noget abnormalt i vores nuværende paradigme. Men de fleste af disse ting vil ikke udvikle sig til noget, og “earlier is better” er formentlig ikke en generealiserbar regel til disse abnormaliteter – tænk fx små aneurismer i hjernens kar som ca 2-5% har; små strokes som ca 10% har >50 år i MR studier. Det er pludselig et spørgsmål om terminologi og definitioner ift den risiko abnormaliteten repræsenterer. Skal vi virkelig fortsætte med at kalde subsegmentale lungeembolier, for embolier? Skal asymptomatiske screeningscancerfund kaldes for “cancer”? Kort sagt, så behøver med mere og mere teknologi, at kende til folks BASELINE abnormaliteter (hvor abnormt er det abnorme? Er en lungeemboli virkelig vigtig, hvis en signifikant del af befolkningen har små lungeembolier?)
- 2: Udvidelse af definitioner af sygdom
Lad os kigge lidt mere på “udvidelse af definitioner af sygdomme”:
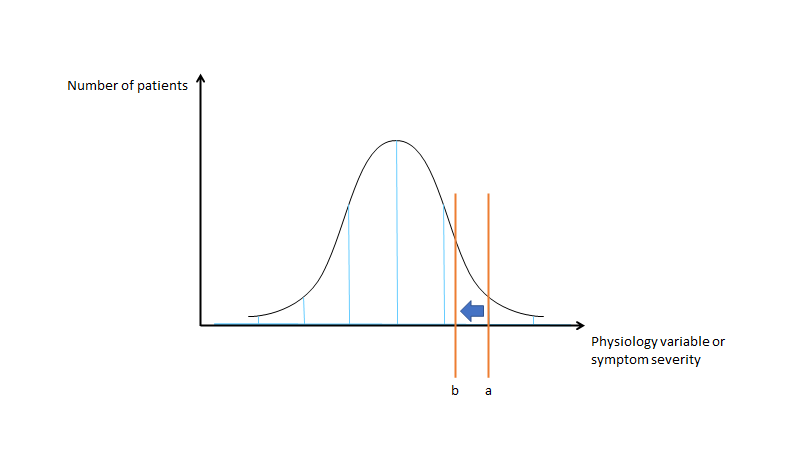
Hvis dette herover er bells-kurven for en given markør (fx HbA1C eller Blodtryk), så vil indikations creep være en udvidelse af de diagnostiske kriterier (fx at hypertension nu er defineret som 140/90 i stedet for 160 / 90), uden et egentligt evidensgrundlag (dvs ofte extrapolering eller “expert oppinion” – se fx stroke-kriterierne også). Bemærk, at selv en lille forskubbelse skaber en enorm mængde flere patienter fordi kurven begynder at blive stejl. Når vi forsøger at sænke blodtrykket hos patienter så er det for at sænke risikoen for AKS / stroke m.m. Men der er vel en grænse?
Som Vikas Saini fra Lown institutet pointerer med bellskurve-problemet illustreret herover, så vil majoriteten af dem vi forsøger at hjælpe med, af AKS og stroke m.m findes i den store midte af bells kurven – ikke i den højre ekstrem. Der er altså et equilibrium, hvor benefit udvejer harms, og hvor det eventuelle fald i risiko for AKS eller stroke ved at give medicin til HELE “midten” af bells kurven paradoxalt vil øge mortaliteten fordi man dør af bivirkningerne når en medicin distribueres til masserne (fordi pludselig er sjældne bivirkninger (1:10.000) ikke så sjældne når millioner får dem).
St Mungos har lavet en af mine favorit kurver som illustrerer dette koncept.
Jo mere Creep og rigere system vi har, der kan øse ressourcer ud (fx give CT til alle i befolkningen), des nærmere bevæger vi os imod højre side af overstående kurve.
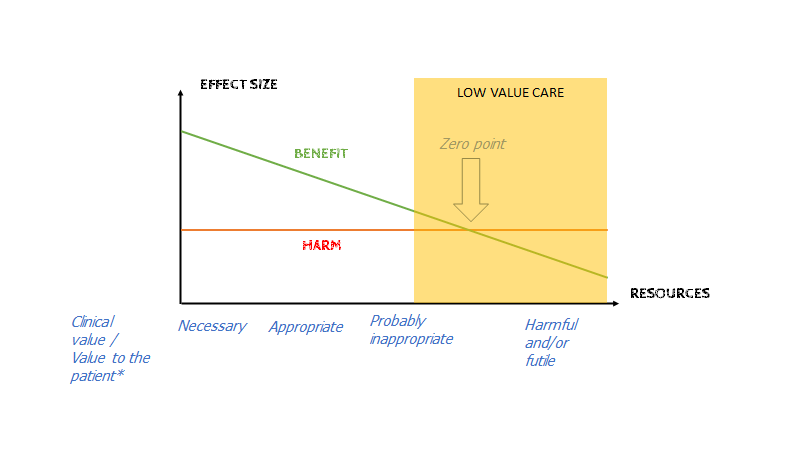
Gilbert Welch har i “overdiagnosed” (bog), lavet en meget lignende graf, som er mere patientorienteret i stedet for system orienteret (denne figur mener jeg er central i moderne medicin, hvorfor den gentages nogle gange i forskellige former i denne blog)
Hør også Gilbert welch selv forklare om grafen
Der er nogle vigtige “caveats” ved den simple (men vigtige) figur herover, som illustrerer et komplekst koncept. Fx
- Harms kurven er lige: Man kan argumentere for og imod at “harms”-stregen skal gå op eller ned eller være lige. Ved fx stroke og trombolyse ved vi, at risikoen er større for blødning, hvis du har et stroke, end hvis du ikke har det. Ligeledes ved operation af alvorlig tilstand, vil harms være større, ved den meget syge (pga fx risiko ved at intubere en instabil patient; fjernelse af ægte patologi er sværere end “incidentalomer” og “mild patologi” etc). Ved de fleste tilstande – særligt ciffer tilstande som DM2, Hypertension etc -, argumenterer Welch, er den nok lige (fx NOAK behandling ved lungeemboli)
- Apples and oranges: Modellen tager ikke højde for individets kvalitative ønske. Nogle “harms” er for individet måske meget værre end nogen mængde benefit, og vice versa. Modellen er med andre ord kvantitativ. Dette er også en kritik af siden TheNNT.com som ligeledes opstiller NNT Vs NNH kvantitativt. Man kan dog til dels løse dette problem ved at opdele NNT og NNH i POO (Patient oriented outcomes), hvor majoriteten vil være enige (fx at få en invaliderende hjerneblødning er noget vi alle er enige om, er en harm man vil undgå).
essensen af modellen kan sammefattes således: The patient most likely to experience net benefit, is the patient with the most severe abnormality
Akutmedicinsk legende og professor, Jerome Hoffman har illustreret overstående pointe igennem en kendt analogi med “gorillacillin”:
For most conditions, the benefit of a given treatment is relative, reducing bad outcomes in a percentage of patients who have the condition. Treatments also produce harm, usually in a fixed percentage of those treated, independent of whether they have the disease for which the treatmentwas intended. For example, consider a new antibiotic, “gorillacillin.” Although gorillacillin is so toxic that it kills 10% of those who receive it, it is tremendously beneficial among patients with the dreaded “infectiosis,” decreasing mortality from 50% to 25%.
Gorillacillin is less attractive, however, when only 20% of treated patients actually have infectiosis; the 10 lives saved among the 20 patients who would have died are completely offset by the 10 drug-related deaths among 100 patients treated. As problematic as this is when diagnosis is difficult— such that many treated patients do not actually have the target disease—it is a massive problem following overdiagnosis. Imagine that all 100 patients actually have infectiosis, but 90% were diagnosed by sophisticated tests performed despite the absence of the classic fearsome symptoms of infectiosis, “just to be sure”—such that precious few have the deadly form of the disease. Since virtually none of these 90 were at risk of dying, gorillacillin would save 5 of the 10 truly at risk, but by killing 10, it would cause net harm! Overdiagnosis inevitably means that many individuals are subjected to the potential harms of treatment while being afforded almost none of its benefits.
Jerome Hoffman, Overdiagnosis of disease – a modern epidemic
At give fra de rige og ta’ fra de fattige – Reverse Robinhood effect og hvordan indication creep og “earlier is better” kan køre sygehus systemet i sænk og overarbejde læger
Det kan alt sammen blive lidt langhåret, men lad os tage et eksempel for hvorfor creep er så farligt: Hvis vi i morgen opfinder “elektronmikroskop-ækvivlanenten for diagnostiske tests” (fx et apple-ur patienten har på, som kan fange små nuancer med big data, som giver lyd fra sig hvis risikoen bliver for stor) for selv en enormt farlig sygdom som AKS så vi kan måle 14 dage før om patienter har tegn til AKS så står vi samme “earlier is better” problem som med screening
- vi “skaber” patienter (majoriteten af dem “i fare” udvikler formentlig ikke tilstanden. Dvs vi skal kende til NNT vs NNH ratioen . Hvor mange skal behandles 21 dage før , 14 dage før 7 dage før for at vi undgår 1 dødsfald eller morbiditet)
- Som fortalt så handler det om “pathway of diaease “ vs “pathway of Health” og hvilken patienten ud fra sit eget ønske (ikke vores) vælger . Disse samtaler tager tid (modsat samtalerne med en aks patient (du har zx, du skal yy etc )). Altså mere ressourcekrævende for den enkelte læge
- Vi må som samfund indse at denne store mængde nye patienter (som forekommer hver gang vi rykker (creeper) lidt til Venstre på Bells kurven , kan håndteres af den mængde læger vi har . Og er det virkelig den mest effektive måde at bruge de ressourcer på ? (I stedet for primær profylakse investering etc)
- Vi må indse at jo mere vi går ned af denne bane (potentiel overdiagnostik af rige , høj socioøko patienter med Low value testing ), jo mere skal vi tænke på “tvillingen” til overdiagnostik : underdiagnostik et andet sted i systemet . Det er på mange måder et “Zero sum game”, fordi summen af ressourcer er finit.
- Og som med al “screening” må vi spørge : er det overensstemmende med medicins “telos”? Risikoen for alle de ekstra PCIer og false alarms er nødt til at vejes op med de liv vi evt redder
Jeg har allerede set de første “apple-ur” takykardier komme ind. Skal vi gå denne vej (og det har jeg stærk tvivl om vi skal) er det nødt til at være kontrolleret, og ikke i hænderne på organisationer der nyder godt af, at sælge flere “apple-urer” og skabe et behov, der ender med at medikalisere store dele af befolkningen, hvor de ikke selv høster konsekvenerne (fx i form af bøder eller at betale for alle sygebesøg der relaterer til apple uret)
Det er altså ekstremt vigtigt at vide hvad “baseline” er for os mennesker, før vi begynder at introducere noget nyt som udredningsværktøj. Hér er de lidt overraskende baseline karakteristika (hvor mange mennesker har det på populationsbasis asymptomatisk) for nogle få udplukkede tilstande
Fra MR studier
- aneurismer i hjernen 2% (Bos et al, 2016)
- Silent Brain Infarction (SBI) i populationsstudier er 18% i medianalderen 62-76 (Gupta et al, 2016)
- Diskus prolaps (50-80%) (brinjiki et al, 2015)
Populationsstudier
- Hypertension Norge (iona Heath ved lown instituttet )
Cancer post-mortem studier (Kilde: https://m.youtube.com/watch?v=NZ5ghiQr2RQ)
- 1-3% har nyrecancer
- 1/3 har små thyroidea cancer
- 60% af mænd >50 år har c.prostata
- 1/3 af kvinder 40-49 har små bryst cancer
Spørgsmålet er kvalitet vs kvantitet – kan det løses ved follow up? (watchFull waiting?) vi gør personer til patienter – er det det værd ?
Bottom line: min holdning til guidelines har ændret sig siden jeg begyndte at læse litteraturen bagom dem. I Danmark tror jeg vi holder et højt niveau, men jeg ser stadig problemer med vores guidelines (interessekonflikter, overmodighed i state-ments, forklarer ikke usikerheden i evidencen, manglende referancer, manglende overensstemmelse mellem guidelines m.m), og måden de præsenteres på ift den setting de er ment for (fx opportunity cost, cognitive load). For akutmedicineren, er det desuden ekstra problematisk, ikke at vide, hvilken population studierne som guidelinen bygger på, er lavet i (da vi ofte ser en mindre syg population end afdelingens læger) – problemet bliver kun større af, at man internationalt ikke har samme slags akutmodtagelse med et stærkt pimær-sektor filter, hvorfor det kan være svært at kalibrere populationen vi arbejder ift fx europæiske guidelienes.
Det mest alvorlige problem med guidelines er dog “erosion of expertise” problemet, som hænger sammen med når vi tænker guidelines som “standard of care”, og “overdiagnostik og defensiv medicin” (som beskrevet i quotes af Gary klein i starten af afsnittet).
Der er dog mange gode ideer med guidelines, og vi kan forbedre dem. Min optimale guideline har udover alle de kvalitets-parametre jeg har nævnt, også en relevant opbygning, som gavner lægen – lidt som en værktøjskasse i stedet for som en kogebog:
- NNT / NNH (ved behandling) (se fx TheNNT.com)
- IRR og LR (se fx theNNT.com)
- Hvilken population er den lavet i (ekstern validering), gerne i form af “inklusionskriterier” (passer den på min patient?)
- Grad af sikkerhed bag evidensen (gerne i en post-test sandsynlighed ala Anand senthis EBM2.0 koncept), og forklar hvor “hullerne” er (i stedet for at dække dem til med en pseudosikkerhed)
- Referencer
- Interessekonflikter tydeligt nævnt – og forsøg på at reducere / blande folk som laver guidelines således at der i det mindste findes forskellige og modsatrettede interessekonflikter (men helst ingen financielle)
Så kan jeg selv bestemme og aftale med min patient, hvilken grad af fordel der er for dem.
Et problem er dog hyperspecialisering. Ser jeg en patientgruppe jeg aldrig har set før, og som jeg aldrig kommer til at se igen, vil jeg også helst gerne bare have en koge-bog at udføre. Men jeg tror stadig overstående principper gør det nemmere at udføre vores opgave som læger, og selv i uvante situationer føre en relevant samtale med patienten om fordele og ulemper.
Skal jeg overhoved følge guidelines?
Trials of newer anticoagulants and longer durations of anticoagulation have not yielded real improvements over heparin, inviting doubts regarding its efficacy. Thus, PE is the quintessential diagnosis of medicine not because it represents our greatest success, but because it captures all the complexity of medicine in the evidence-based era. It may serve as a metaphor for many other conditions in medicine, including coronary artery disease.
New trials in the field continue to test trivialities, whereas fundamental questions are unanswered
Prasad et al, 2012: The Diagnosis and Treatment of Pulmonary Embolism – A Metaphor for Medicine in the Evidence-Based Medicine Era
Procedures [i.e guidelines, algorithms etc] help when you need people to reliably follow the same steps. However, that’s different from needing reliable outcomes
Gary Klein, Streetlights and Shadows
A blacksmith must bring the hammer down at the same point stroke after stroke, yet we do not care if the arc of the hammer is the same each time
Hvor får du din viden fra? Hvor ved du det, du ved om et stof fra? Er den kilde valid?
I højere og højere grad er det svært for læger at svare på disse spørgsmål, hvorfor “critical appraisal” (del 1a) er blevet altmere vigtigt. Det skal i samme åndedræt pointeres (som jeg gjorde i del 1a), at distributionen af viden og opdatering af viden er et enormt blindspot i vores system. Det er enormt ineffektivt, og derfor er mange af metoderne det medico-industrielle-kompleks anvender til marketing (reklamer, guidelines, drugreps etc) i virkeligheden et symptom på vores egen inabilitet at uddanne os godt nok. Det burde være et rødt flag, når de der sælger et drug er nødt til at spendere 50% af deres budget på bare at få drugget ud til os. Sidenote: Tjek konceptet “seeding trial” – måden dette sker på er blevet mere og mere kreativt, og hvis du tror du ikke influeres af det…så tro om.
Okay, med alt det her misinformation og signal-noise ratio, og “guidelines som anvendes som reklame”. Er der nogen årsag til at følge det lige nu?
På de fleste sygehuse er det okay at fravige sig guidelines med et argument for hvorfor man gør det. Dette er dog særligt forbeholdt erfarne læger, og selv da, efter konferering med andre kollegaer.
Vi må ændre systemet, men på egen hånd at fravige guidelines (hvor man ikke altid har styr på signal-noise) er risikabelt, medmindre man ved, hvad man laver (jeg gør det sjældent, og kun efter konferering med kollega – alt efter situation). Mener jeg, at fx trombolyse, burde gå tilbage til square 1, hvis vi skal fortsætte at anvende det i den grad vi gør? Ja. Undlader jeg at give trombolyse? Nej. Jeg forsøger at have samtaler med mine kollegaer, og skrive blogs og undervise om emnet.
Mange gange er “fravigelse af guidelines” ikke noget, jeg aktivt vil gøre af princip, bare fordi jeg tror det er skadeligt- eller ikke nyttigt.
Om patienten får PPI for sin akutte øvre GI blødning fordi kirurgen gerne vil have det, betyder ikke noget – jeg kan altid forsøge at undervise på afdelingen om området. Der jeg kan “ændre min beslutning” ud fra min viden er fx følgende: Mener jeg, at punkt 3 af de 10 punkter i guidelinen er meget vigtigere end punkt 1 og 2, vil jeg i stedet vælge dén først – særligt i en situation, hvor det er vigtigt. Uvigtig medicin, som generelt er ufarlig er kun farlig, hvis den inducerer opportunity cost (vi nåede ikke at give antibiotika, fordi patienten skulle have sin C-vitamin og tiamin!). Jeg vil desuden i højere grad undervise mine patienter om harms Vs benefit ved behandlingen (hvilket vi selvfølgelig altid bør gøre…men kan ofte blive “endnu en boks der skal tjekkes af”, uden egentlig at have samtalen med patienten).
Det handler om at spørge sig selv: Is this the hill I want to die on? eller på dansk vil vi nok sige “det handler om at vælge sine kampe”
Vi skal vedligeholde gode forhold til vores kollegaer (Fx kirurgen og neurologen), hvilket kan være en meget vigtigere effekt end medicinen, for patientens forløb. Optimalt lærer man dem at kende inden man kommer i akutte situationer. Det eventuelle mindre problem, som PPI giver patienten (bivirkning eller opportunity cost) er sjældent vigtigere, end at skade det forhold jeg har med kollegaerne. Jeg har trukket grænsen ved trombolyse af NIHSS <5 patienter på 4 timer og 20 min på mit hospital, men selv da, er det med en respekt for mine kollegaer og en fælles samtale om hvad er bedst for patienten. Jeg er ikke fuldt enig i alt Cliff Reid siger om dette område (jeg synes mere om “spotting the right” og ydmyghed end de mere manipulative teknikker som Reid beskriver – jeg har dog været på kursus med ham og talt med ham, og han anbefaler også “spotting the right teknikkerne” fx “for min egen læring” eller anvend mindsettet: “hvad er det du ser, jeg ikke ser, som kan gavne vores patient lige nu, og som gør, at du ønsker en anden vej i håndteringen?”. Det er smag og behag og afhængigt af situation), men det kan være du er, og derfor anbefaler jeg alle at se denne video, for at tale med andre specialer i svære situationer.
How to disagree: Det såkaldte “grahams hierachy of disagreement” fortæller os, at der er mange måder at være uenige på, og at man sagtens kan være interlektuelt uenige og arbejde sammen
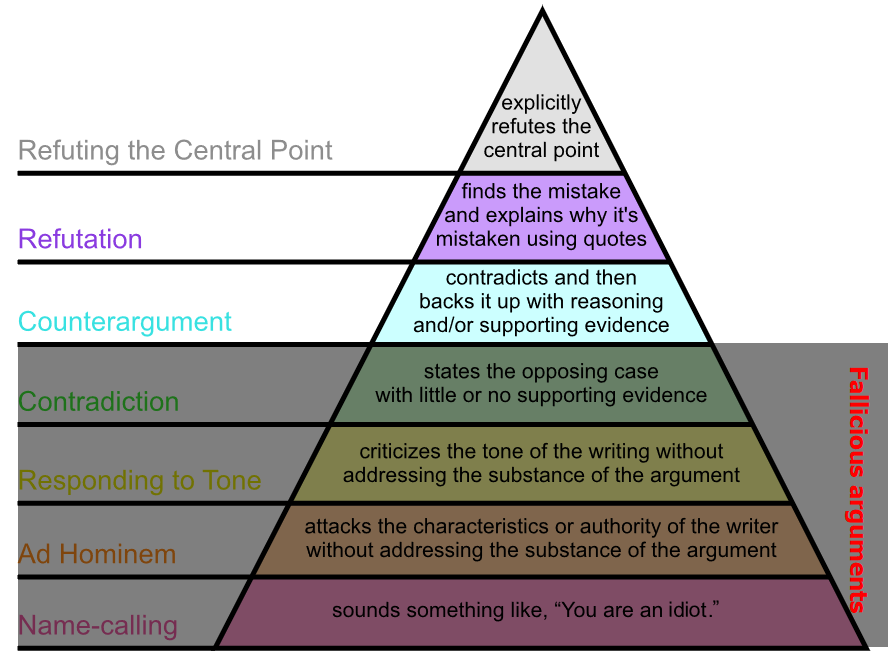
Ken Milne (som er vant til at argumentere indenfor dette område), advarer os ofte om såkaldte “logical fallacies” (fallacious arguments – se fx de 4 nederste niveauer af pyramiden herover), som ofte er patos-argumenter. Det kan derfor være godt at kende til nogle af disse (stor version)

Personligt, vil jeg sige, at det er lettere sagt end gjort, fordi vi ikke tænker over det i hverdagen. Men vi bliver aldrig bedre, hvis vi ikke øver os eller kender til koncepterne
Et logisk argument, som jeg dog synes er ganske åbenlyst angående dette koncept med at følge guidelines er følgende: Hvis det menes, at læger skal følge guidelines (fx “get with the guidelines”-kampagner og lignende), så burde de, der laver guidelines OGSÅ følge guidelines om at lave guidelines (fx ingen interessekonflikter etc).
Jeanne Lenzer, Ioannidis og Hoffman et al, 2013: Ensuring the integrity of clinical practice guidelines: a tool for protecting patients (se box 1 herunder)

Før overstående er bedre addreseret end nu, tror jeg ikke vi bliver tilfredse med nuværende guideline system.
4.-5.: Risk litteracy
Som beskrevet i diskussionen herover, så er der med andre ord et helt bestemt tidspunkt i udredningen af din patient, hvor du gør mere skade end gavn, og det er formentlig en del tidligere end du tror. Er din patient lav-risiko, bør vi i hvert fald tale med dem, om de risici, således at de med vores eksperthjælp, selv kan beslutte om de vil gå den ene vej (risiko for overbehandling er de mindre bange for end risiko for underbehandling – uanset hvor relativt forskellige de måtte være) eller den anden vej (fx wait and see , da de fleste tilstande går i sig selv og er “rough and tumble of life”, alt efter hvor tydelig patologien er)
Shared decision making sounds nice , but how can you share in decision making if the two players lack the evidence or cannot understand / make sense of the evidence
John Ioannidis, Reducing waste in Research (ScanFOAM)
Dette emne kaldet “Risk litteracy” / “Health litteracy”, er formentlig (forhåbentligt) fremtiden indenfor sundhed. Det er et emne for en anden gang, men tjek et af de ledende steder for risk litteracy, Gerd Gigerenzers Hardinger center (og deres faktabokse).
Kan vi informere vores patienter om det man i Holland siger er de tre vigtige spørgsmål en patient skal spørge sin læge om (lyt til denne podcast for detaljer)
- 1: Hvad er mine muligheder (inkl “watchfull waiting”)
- 2: Hvad er chancen for pro’s (NNT) og risikoen for con’s (NNH) ved behandlingen (og hvor sikker er vi på, at det er sådan = hvad er graden af evidens, og sandsynligheden for at denne evidens skifter til næste år)
- 3: Hvad anbefaler du (som lægelig ekspert) mig (som ekspert i mig selv), efter det du ved om mig
Får vi først værktøjer til at have disse samtaler, vil elementer som usikkerhed (tolerating uncertainty), og overdiagnostik være lettere at håndtere igennem samtale (dog aldrig forsvinde). Det er ikke løsningen til alt, men en vigtig bid af løsningen (obs: jeg mener ikke, at vi skal (eller kan) reducere mange af vores usikkerheder til tal – flere argumenter for, hvorfor dette er problematisk i denne udmærkede blog)
Du mener måske vi har de værtøjer lige nu?
Se om du kan svare på de spørgsmål på vanlige behandlinger for STEMI (OMI), NSTEMI (OMI) og NSTEMI (NOMI). Eller hvad med Lungeemboli? Hvad er NNH for alvorlige blødninger? (mellem 2-6 % for all-comers alt efter studiet man kigger på)
Jeg mener ikke det er tilfældet
Kan du forskellen mellem overdiagnostik, falsk-positiv og incidentalom? Og hvad vigigere er, hvordan vil du kommunikere disse koncepter til dine patienter?
Man skal have tungen lige i munden når man forklarer patienten om det, men det er vigtigt at kende til (se fx Brodersens artikel om emnet)
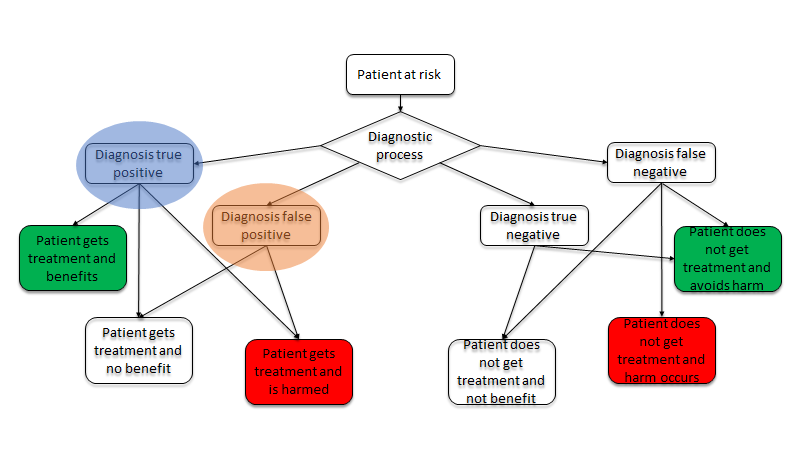
Som jeg forstår det, så er det således:
Overdiagnostik (markeret med blå i figuren herover): er egentlig en sand positiv – i mikroskopet / på CT skanningen etc ser den ud som den sygdom man udreder for. Det er af denne anledning at Jerome Hoffman spørger i sit lektur om overdiagnostik, hvad der kommer til at ske når vi får “elektronmikroskoper” som CT skanning for LE. I virkeligheden bør vi tænke sandt-positive som sandsynligheder eller en ratio – positive som er selv-limiterende Vs positive som ikke er selvlimiterende Vs positive som er selvlimiterende, og som er reversible).
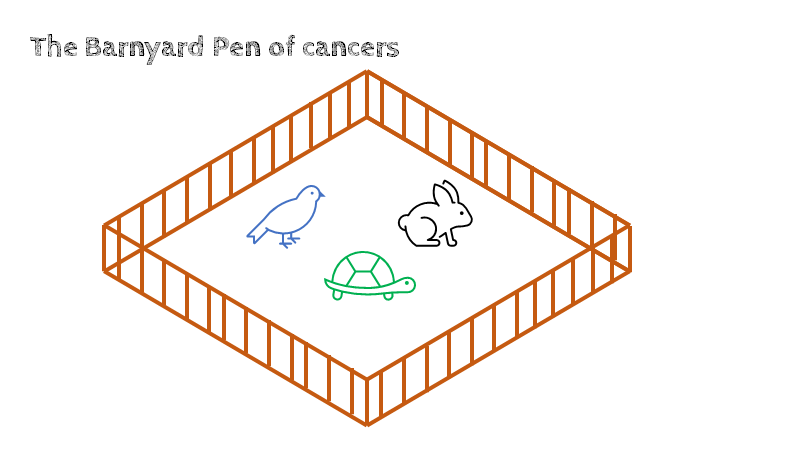
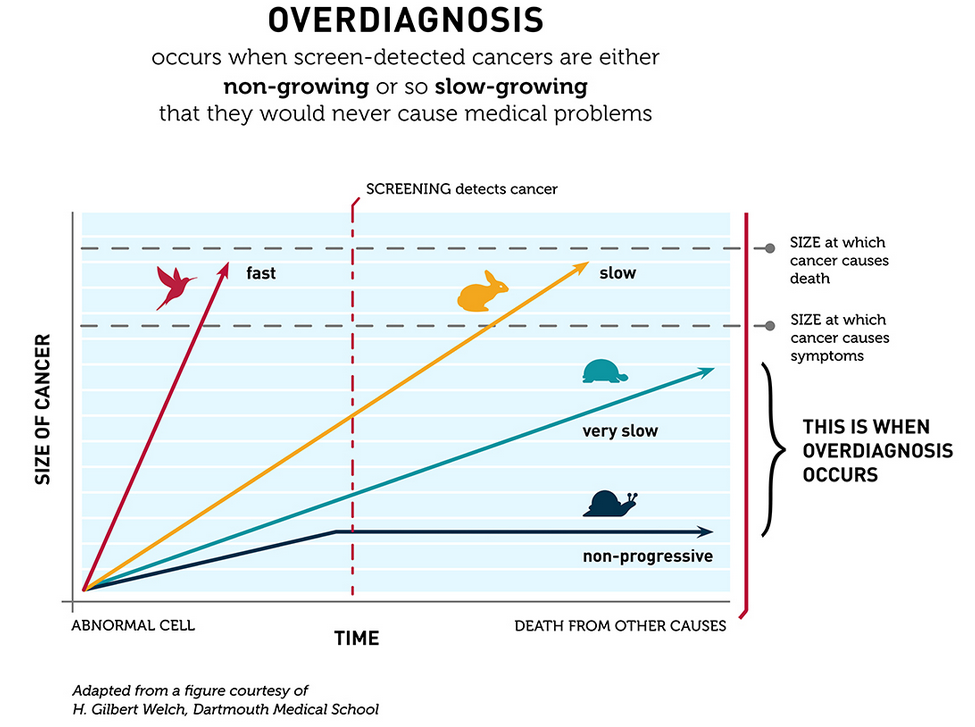
Gilbert Welch (forfatter af bogen “overdiagnosed”), anvender en analogi om cancer, som formentlig kan extrapoleres til andre slags diagnose-områder (Fx lungeemboli eller CAD). Den kaldes “The Barnyard analogy of cancer“, og forsøger at forklare at cancer er et spektrum, der symboliseres i form af forskellige dyr (fugl, skildpadde og kanin). Diagnostik- og behandling er “hegnet” i analogien, der skal forsøge at fange dyrene. Ift min angivne ratio, kalder han den føste del af ratioen for “skildpadder” (positive og selv-limiterende eller ting som man dør med, ikke af – uanset hvad vi gør, så flygter de ikke). Den midterste del kaldes fugle (positive ting som ikke er selvlimiterende, men som vi aldrig kan fange med et hegn – de er fløjet uanset hvad vi gør), og den sidste del (som vi er mest interesserede i), kaldes for kaniner .For flere og flere ting i vores hverdag finder vi bare flere skildpadder – det er de letteste at behandle (de bliver bedre af sig selv). Imens går mindre forskning til kaninerne (al overdiagnostik betyder underdiagnostik et andet sted i systemet)
Termen overdiagnostik er altså først noget vi ved bagefter, når vi laver statistik på det, og det er således en epidemiologisk term. Lidt som, at man ikke var sikker på at rygning var farligt, men at når epidemiologer forskerede på, det var det meget tydeligt farligt – tænk bare på de bivkrininger eller den kæde af undersøgelser (for ikke at tale om, at de nu er “patienter” og fået “sygdoms”-passet, som Iona Heath forklarer) vi udsætter patienter for, hvis vi funder “noget” på deres undersøgelse. Lidt som med tobak-industriens restriktioner og informationen om farligheden ved tobak har mindsket forbruget, er vi nødt til at udføre systemløsninger for at afhjælpe med overdiagnostik.
Falsk positive (den røde cirkel i figuren herover): Dette er noget, som egentlig ikke var positivt. Kommer du tilbage i morgen eller lader du en anden kigge på undersøgelsen, eller laver du undersøgelsen igen, vil du se, at resultatet har normaliseret sig. Dette ses fx ved den analytiske variation i blodprøver, som alle kan have godt at kende til – se fx McCormack et al, 2018 (your results may vary)
Incidentalomer: Findes ikke på figuren. Det er “noise”. Fx når vi ønsker at undersøge lungen, og finder en cyste på nyren på den CT skannings abdomen-vindue som bestiltes. Incidentalomer handler om Baseline og vores (manglende) kendskab til variationer i kroppen, og vores manglende evne til at skelne kaniner fra skidpadder. Det kan være du bliver bange for et aneurisme i hjernen som bifund til din CT angio indtil du læser statistikken om, at ca 4-5% af os har det (uptodate). Eksempler findes overalt: MR skanninger af rygpatienter hvor majoriteten har små forandringer; Mindre stroke-forandringer (ca 10% har det på CT efter 60 års alderen) m.m. Som med alle bifund, er det en kvalitativ forskel, og er der fx mange og/eller store aneurismer på unge patienter, så må man overveje om risikoen ikke er stor nok til at gå videre med mere aggressiv undersøgelse. Dette er dog sjældent.
At kommunikere overstående koncepter før undersøgelser, til patienten: At kommunikere det til patienten er straks værre. Det afhænger af patientne og situationen. Til at starte med, en tommelfingerregel: Inden enhver større undersøgelse (fx CT eller MR) vil jeg give en advarsel for, at vi kan finde noget, som man ikke nødvendigvis kan fortolke, men som ikke er det vi leder efter (særligt ved urolige patienter).
Mine metoder: Har jeg opnået en alliance med patienten vil jeg såfremt jeg bedømmer patientens risiko lav, enten være paternalistisk og sige “du er rask” (hvis det er det, de behøver at høre – fx ifb uro). Dette advokeres i nogle situationer af Bernard Lown (The lost art of healing), Suzanne O’sullivan (it’s all in your head) og min gode kollega og ven Andreas Skalleberg. En anden metode er at empatisk forklare, at på nuværende tidspunkt i diagnostikken (lav risiko), vil jeg som ekspert anbefale, at man ikke går videre, me i stedet “venter” og ser om det ikke går over (som jeg tror det gør), da jeg er bange for, at mere diagnostik / behandling vil skade, og jeg vil helst gøre det bedste for min patient (se del 2 – “the fiduciary”). Har jeg tid, og har jeg indtryk af, at patienten ønsker lidt mere information, kan jeg vælge at gå i en SDM (shared decision making vej), hvor jeg illustrerer patientens risiko (beskrevet i “overdiagnosed” bogen af Gilbert Welch): Der er to veje at vælge, og begge har sine risici – det er med andre ord op til dig som patient ift hvilken risiko du bedst kan leve med.
[vej 1 “pursuit of health”] Some may prefer to pursure health to focus on feeling healthy and minimize medical contact while they are well. They may accept a slighly higher chance of death or dissability to minimize the chance of medicalization, overdiagnosis and ovetreatment now. They prefer to reserve medical care for problems that are obvious to them
[vej 2 “pursuit of disease”] Others may want to pursue disease: do everything they possibly can to be healthy in the future and to decrease their chances of experiencing death or dissability – even with the knowledge that they are more likely to be diagnosed with disease, more likely to be frequently exposed to medical care, and more likely to suffer harm. They prefer to work to avoid death and choose to allow medical care to assume a larger role in their life. Many view this [vej 2] as the best strategy to stay well. But it is difficult to promote wellness when actively looking for things to be wrong. In the effort find out that everything is okay, people pursue early diagnosis. Ironically, this strategy increases the chances that they’ll be told something is wrongGIlbert Welch et al, Overdiagnosis s. 185
Jeg kan nogen gange opsummere dette, når patienten spørger “men hvad er der så galt?” (når man har udredt det vigtigste i akutmodtagelsen): Det er oftest når vi ønsker at vide “hvad der er galt”, selv når risikoen er lav, at vi lider skade under udredningen (den ekstra viden er ofte dyrt købt). Hellere anvende “time as a test”, og enten undersøge rigtigt når sandsynligheden er større, eller også går tilstanden i sig selv (selvfølgelig alt efter hvor man er i forløbet). Sagt på en anden måde: “Earlier is better” er en sandhed med mange vigtige modifikationer. Eller min favorit: you cannot prove a negative (har symptomet fx en ikke-somatisk anledning som den ofte har, vil det være umuligt nogensinde af finde en empirisk anledning – vi skal med andre ord være bekvæmme med at stille diagnoser uden tests)
Sidstnævnte metode kræver risk litteracy, som litteraturen desværre fortæller os er problematisk for de fleste (inkl læger). Se fx dette studie og dette studie (Tammy hoffman et al, Patients’ Expectations of the Benefits and Harms of Treatments, Screening, and Tests A Systematic Review), som fortæller os, at læger generelt overvurderer benefit, og undervurderer harm.
Overstående er ikke one-size fit all, og jeg vil gerne høre, hvis I har andre metoder eller studier, der forklarer hvordan vi bedst kan informere vores patienter om disse komplekse emner på kort tid i akutmodtagealsen. Jeg ved at Jerome Hoffman mener, at dette er udover hvad vi som læger kan, og det handler om at informere folk før de kommer i situationen (dvs risk litteracy på skoleprogrammet, som Gerd Gigerenzer også er fortaler for)
Hele overstående diskussion kan grafisk fremstilles således, og det er sådan jeg anvender det i min hverdag:
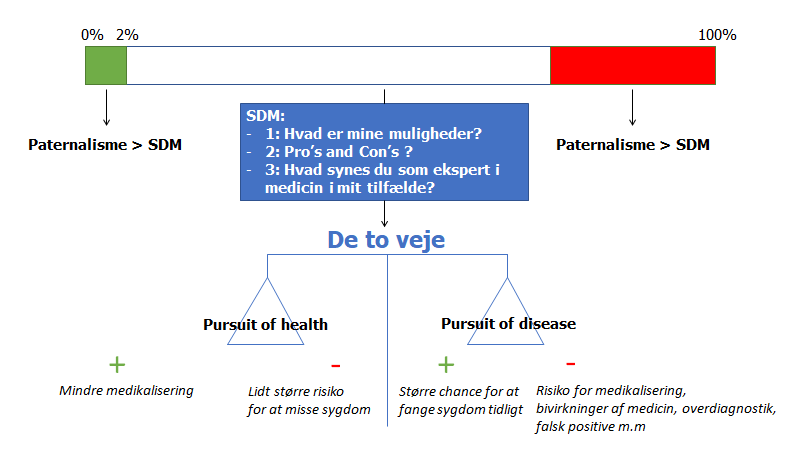
Ligeledes, hvis sandsynligheden for alvorlig sygdom er høj, skal jeg ikke udføre for meget SDM (medmindre patienten fx er meget gammel og ikke kan overleve behandlingen – jf min blog om the thresholdmodel for detaljer – fx akutmedicineren best of 2020 del 2).
Majoriteten af mine patienter, vil dog falde ind imellem, hvor jeg enten må bestille flere tests, for at få dem ind i en af de to overnævnte grupper, eller hvis det ikke er muligt eller ønskværdigt, tale med patienten med SDM-værktøjskassen i hånden. De 3 spørgsmål i den blå boks kan være gode at guide hér, samt risk-litteracy ideen, og at patienten og lægens møde er et møde mellem to eksperter (jf også del 2 af denne blog). I sidste ende må vi igennem samtalen også vurdere, hvad patientens interesse er: hvad er deres risk aversiveness, og hvilke risici føler de er mest ubehagelige at arbejde med (vej 1 Vs vej 2, som illustreret på vægt-skalaen herover – jf de to veje beskrevet af Gilbert Welch i Overdiagnosed quoten herover)
*Ideen herover er inspireret af BroomDocs Casey Parker i sin forelæsning om Bayes
**Har patienten en betydelig risiko for en akut, reversibel og livstruende sygdom udvides den “røde” del af figuren, således at man som læge vil presse mere på for at overbevise patienten om fordelen ved behandlingen
At udrede milde symptomer aggressivt: Et positivt feedback system
Et af problemerne ved den overdiagnostik der er beskrevet herover er, at den er selvgenererende . Allen Francis forklarer fra en synspunkt i psykiatrien:
The best customer for a drug is someone who is basically well. Because of the placebo effect people who are basically well will show the highest percent of satisfaction with treatment . They would get better without treatment (regression to the mean ), they’d get better with pill placebo. But if they are on medication they don’t need they will attribute the improvement in the way they feel to that medication . So the combination of people wanting solutions to problems that sometimes don’t lend themselves to pill solutions , greedy drug companies pushing sickness […] the insurance companies […] require diagnosis for payment early in the course of seeing a patient […] if someone is forced to give a diagnosis and give medication early in the contact[…]then it’s very likely that that person will be put on a medication that they don’t need
Allen Francis, 7-8:30, https://m.soundcloud.com/therecodo/02-dr-allen-frances-leading-us-psychiatrist-author-of-twilight-of-american-sanity
Denne effekt ses indenfor screening, og har fået et navn (“the popularity paradox”): Lad os sige, at en screeningtest danner 9 overdiagnoser, og 1 ægte diagnose (dette er ganske realistisk). Problemet med overdiagnostik er, at vi aldrig ved om det var overdiagnostik. Alle 10 vil mene, at de er den, der blev “reddet” af “earlier is better”-paradigmet. Majoriteten af dem, vil hermed kunne kalde sig “overlevere” (fx hvis det var cancer), og komme med i patientorganisationer (ofte betydeligt støttet af farma-industrien), skabe folkelige kampagner, hvor man årligt fejrer overlevelsen i et tv-program. Pludselig kender alle til “screeningsmetoden der redder liv”, og al rationalitet er ude af vinduet.
Kigger man rationelt på det er sagen mindre clear-cut: Ioannidis et al, 2019: Time to abandon early detection cancer screening
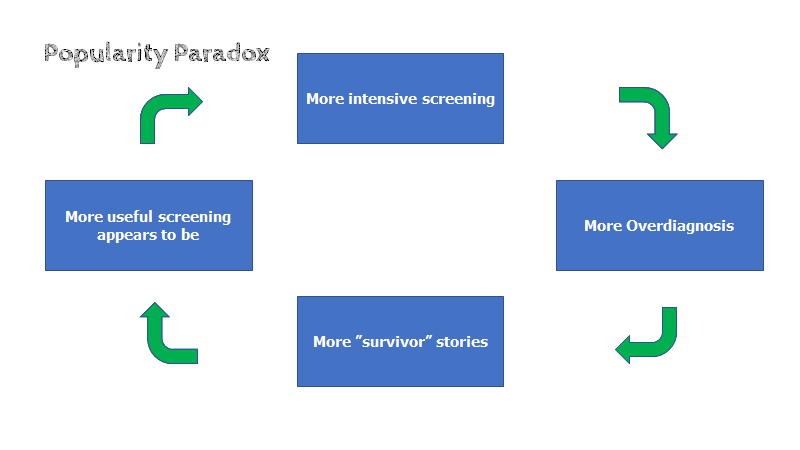
Eksemplerne der anvendes handler om cancer (fordi det er tydeligt og bedst studeret), men lungeemboli, CAD Vs AKS m.m er områder der i akutmedicin har lignende problemstillinger.
Overdiagnostik er som bekendt først noget man ved bagefter (fx ved obduktion – døde patienten af- eller med sygdommen?). Vi kan dog på kurver finde ud af, om en diagnostisk strategi og behandling virker. Normalt vil vi forvente at kurven for en effektiv behandling ser således ud
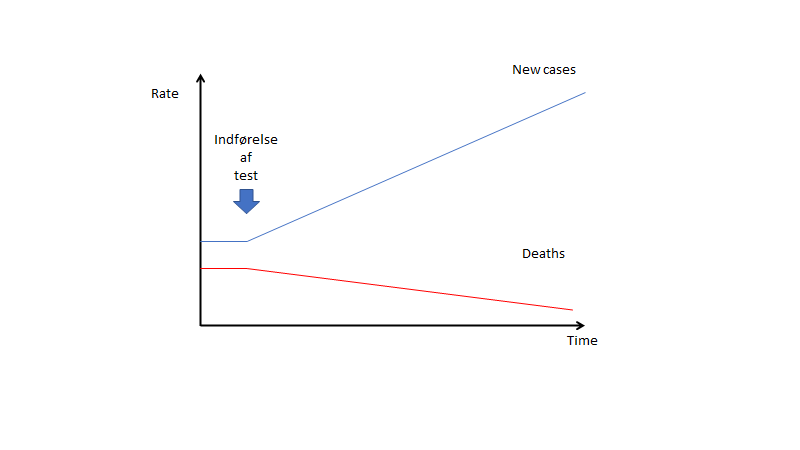
Efter indførelsen af testen falder dødstallet (eller en anden POO). En ubrugelig test vil man forestille sig så således ud:
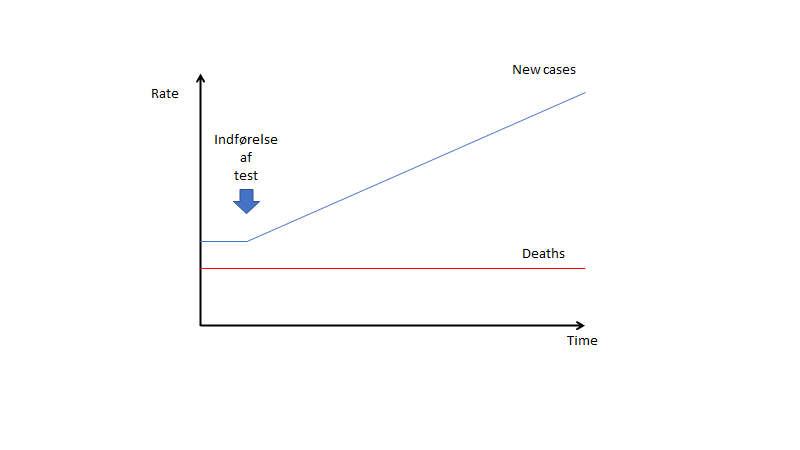
Trods indførelsen af testen findes ingen ændring i dødsfald. Er testen- og behandlingen direkte farlig, vil man forvente at døds-tallet stiger (såfremt at “det patienten dør af” registreres – ofte registreres ikke “all cause mortality”, men blot “disease-specific mortality”. Dør patienten som fik Eliquis for sin lungeemboli af en blødning, dør de jo ikke af lungeemboli – vi misser ofte den slags registreringer, og bl.a. derfor misser vi formentligt når døds-kurverne går opad ved visse behandlinger)
Okay – hvis vi nu kigger på kurver fra virkelighedens hhv
Men 5 års overlevelsen med sygdommen går jo op i studierne!?
Godt du tog det op. 5 year survival siger noget om, hvor mange der har overlevet MED diagnosen. Men hvis vi fx med en screenings test for cancer, finder mange flere “ekstremt tidlige” tilfælde af sygdommen (tilfælde vi nu ved, ofte går i sig selv den behandling, eller folk dør med og ikke af), så vil, simpelt sagt, “fortynde” alvorligheden af at få diagnosen.
Det er lidt nørdet (dog handler det om relativ Vs absolut-problemet), men ganske intutivt. Jeg forsøger ofte at forklare det med koncentrationer i et glas:
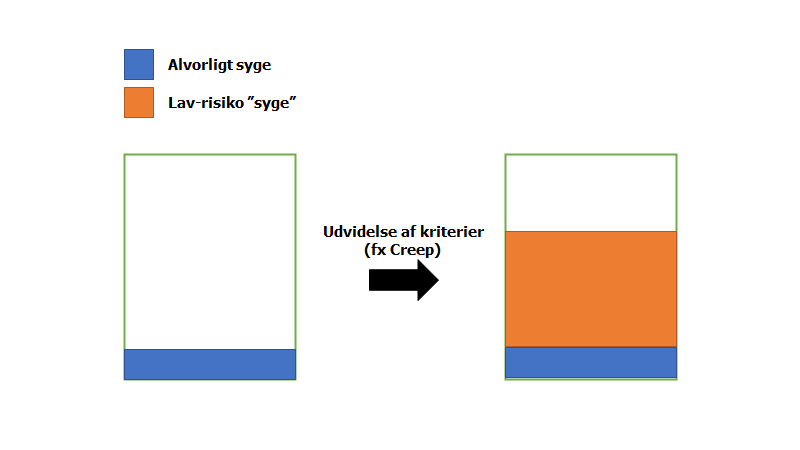
Før man begynder at screene / finde lav-risiko populationer med evt sygdom, vil sygdomsspektret se ud som til venstre i figuren herover (nogle med alvorlig sygdom). Til højre vil der ske en fortynding af “koncentration” af sygdom ved at man smidder en masse nye “mildere” risiko-fakorer & lavrisiko tilstande ind, og kalder dem ved samme navn som originale sygdom. Spørgers man til overlevelse i gruppen til højre, vil man pludselig have bedret overlevelsen betydeligt (uanset hvad du havde gjort), fordi 7/8 af tilstandene går over af sig selv, eller er så lav risiko, at folk dør med deres sygdom i stedet for af den. De absolutte tal på mængden af patienter, der dør med alvorlig sygdom, er ikke desto mindre den samme.
Først fra lægens perspektiv
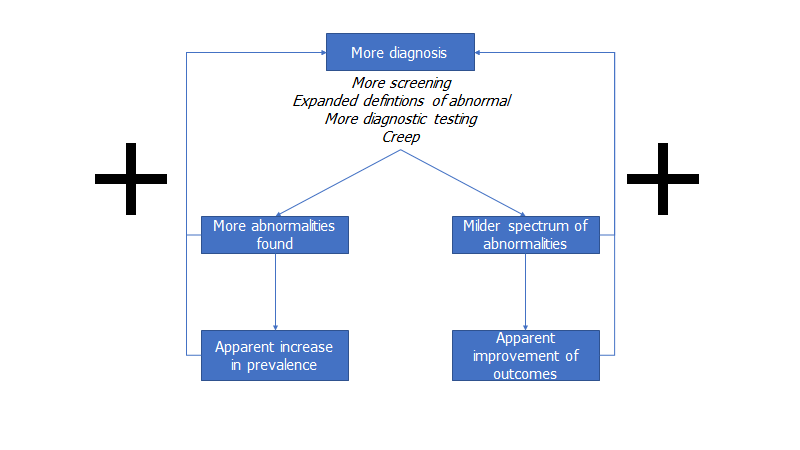
Men hvorfor stiger prævalensen, og outcomes forbedres? Dette er ikke nødvendigvis intuitivt. Det er generelt svært at vide, om en ændring er pga behandlingen vi giver, eller om det er pga fortynding af definitioner (flere diagnosticeres). Dette problem så vi også med C19 når man begyndte at teste mange.
Fra patientens perspektiv
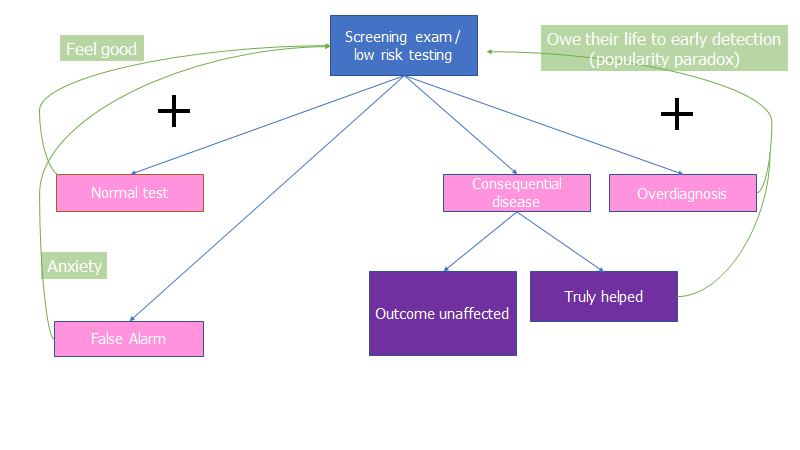
Kort sagt, så vil patienten uanset ouicome af testen føle at de behøver at gøre det igen / sige til deres venner, at de også bør gøre det.
Dette gælder også din patient med lungeemboli, eller med AKS. Hvis du undlader at bestille undersøgelsen, vil en anden gøre det i morgen. Finde “noget”, og patienten vil være glad for at “det blev fundet”. I værste fald, vil du kunne anklages fordi du ikke “fandt noget” (som vi skal komme ind på i del 2, er det ofte kommunikaton der er løsningen her).
Dette problem er særlig stort, da vi ved vi har begrænsede ressourcer, og enhver form for overdiagnostik og overbehandling (hos de der har mulighed for at få den), skaber underdiagnostik- og underbehandling et andet sted i systemet (for dem, der behøver det). En såkaldt “reverse robinhood”-effekt
Suk…hvordan endte vi hér?
Igen et komplext spørgsmål, som jeg bestemt ikke har hele svaret på. Det korte svar: fordi vi tillod det.
Det længere svar er historie for en anden blog. En stor del af årsagen er dog interessekonflikter-, lobbyisme-, og et ønske om innovation og derfor de-regulering, og særligt løsning af regler for industrien i 80’erne (kaldet neoliberalisme)
Selvom det allerede så småt begyndte i 50’erne med de mange teknologiske kvante-spring der gjordes, og en (over)tro på dennes egenskaber (såkaldte medicinens guldalder). Flere af kilderne (i referencerne herover) mener dog, at rigtig slemt blev det nok først siden man omkring 80’erne (Thatcher og Reagan) begyndte at fjerne restriktionerne på det frie marked; såkaldt neoliberalisme
Jeg vil forsøge at lave en blog om lederskab, og hele denne process engang. Indtil videre, vil jeg efterlade denne del af diskussionen med et provokerende spørgsmål:
Skal politikere, virkelig være så tæt på beslutningerne i sundhed? (bør det ikke være op til sundhedspersonale)
Politikere bruger hele deres karriere på at komme “ind i politik”. Når de er dér, så handler det om at blive dér. John Oliver interviewede tidligere i sin karriere en amerikansk politiker, der sagde det hele i en nødeskal:
John Oliver: What makes a politician successfull?
Jim Manley: Getting re-elected by his / her constituants (getting legislation done is second)
The Daily Show: Gun Control and Political Suicide
Og hér er problemet. Vi har skabt et system (eller glemt at opdatere ?), hvor vores lederes prioritering er at blive genvalgt. Det er forståeligt, fordi det er deres karriere. På samme måde som det er forståeligt, at medico-industrielle-komplexet, ikke er onde – det spiller bare spillet som systemet er designet efter.
Så det er lavt hængende frugt for en politiker der vil genvælges, at gå med fx kræftens bekæmpelse (fordi den er folkelig, og generelt velanset – på trods af den lobbyisme, og betaling der sker til alle patientforeninger fra farma-industrien, netop for at påvirke læger igennem politikere / patienter i patientforeningen), eller skabe uhensigtsmæssige løfter om “dette skal aldrig ske igen”, efter en medie-sensationaliseret patientfejl. Det HJÆLPER IKKE, og BLAND JER UDENOM, er generelt det man ønsker at sige….og den ineffektive, og uhellige cirkel mellem politik, medico-industrielle komplexet og bl.a patientforeninger med “survivor stories” fortsætter. Morten Bjørn Hoffman (Too Much Technolgy, 2015), beskriver dette i ét billede:
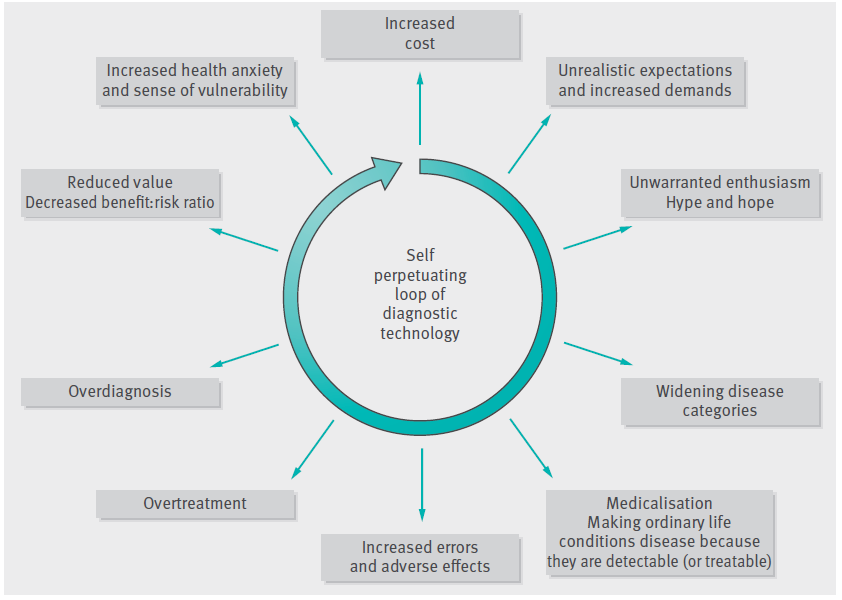
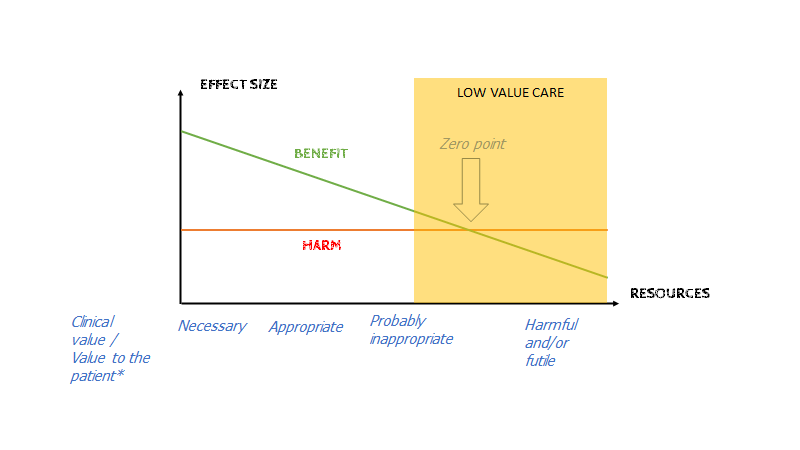
Hvilket fører os fra venstre side af følgende graf, til højre som følge af processer som indication creep. Mere og mere ineffektiv- og ulige sundhedsydelser (Low value care med en høj Harm:Benefit ratio)
Alt det her er vel bare i USA og ikke i Skandinavien?
Skandinavien – og i min erfaring særligt Danmark – er unikt. Vi har en velfunderet sundhedssystem som bygger på almen praksis, kontinuitet og ved behov hospital-hjælp.
Vi investerer i sociale præventive tiltag (uddannelse, socialt sikkerhedsnet m.m), som virker til at være betydeligt mere effektivt for befolkningssundhed end nogen form for hospitals-medicin.
Men det vil være naivt at tro, at USA (med majoriteten af forskning), patientforeninger (med støtte fra farma-industrien) og internationale guidelines-komiteer ikke har indflydelse. Desuden læser patienten nu over internettet, således de inspireres fra andre landes tendenser- og reklamer. Har du ikke allerede et begreb om “ekko-kammer” problemet i din feed, så tjek Tristan Harris forklare i den nye dokumentar “the social dilemma”
Vores styreformer (herunder LEAN og Value-Based Health Care som desværre lyder som noget, der kunne være godt, men som så meget for-profit markedsøkonomi overført til sundhed, så vil økonomien vinde i prioritering over patienten – en blog findes i rørene om dette koncept også, men indtil da, kan man læse den fantastiske bog “Konsulterna – Kampen om Karolinska”, der vil få enhver kritiker af Sundhedsplatformen til at ånde lettet op, over hvor galt det kunne være gået)
The dogma “If you can’t measure it you can’t manage it” is absurd and destructive . That idea murders spirit and dumbs down meaningful improvement
Don Berwick, youtube: Keynote Three: I have changed my mind. Donald M Berwick and Maureen Bisognano
Measurement is always wrong (every measurement contains error, cast a shadow over meaning , it’s always reductions i.e never really what we mean). They are a shadow of a shadow . We have something we care about (love, resilience , caring etc) and we create a construct that is a faulty representative of what really matters. Then we add another layer which is to measure that construct […] measurement distances us from reality . It always produces misunderstanding unless it’s tames by conversation . Measurement is a poor man’s conversation
The cost of measurement: when overreliant on measurement , costs sore . 1: the measurement itself costs , 2: the costs grow in cycles: the [complex] field engages countermeasures (I.e like game-y-fying the 4 h rule) , and then you have to engage in counter-counter measures. You end up in the gaming cycle that absorbs billions of dollars and countless hours , 3: opportunity cost / loss of meaning
Vores politikere charmes formentlig også af farma-industrien og andre lobbyorganisationer som farma-industrien har tråde til. Vores politikere skal stadig vinde valg, i stedet for at vinde det bedste for patienten. De forstår sig stadig ikke på komplekse systemer, men skal styre vores hverdag.
Vores fejlkultur bevidner fortsat om en naivitet overfor “mirakel medicin”, og en dyb manglende forståelse for koncepter som psykologisk sikkerhed, learn-not-blame og hindsight bias.
Og kæden jeg har beksrevet i starten af denne blog (research -> regulation -> guidelines / journals -> klinikeren -> patienten) er stadig den samme i Danmark, som alle andre steder, og derfor med risiko for store fejl
Vi har formentlig den bedste version af alt dette i verden. Men vi er nødt til at blive ved med at kæmpe for ikke at falde bagud med alle de pres der kommer udefra (og formentlig allerede til dels er en del af hvad vi laver)
Ekkokamre: Vi (læger) er en stor del af problemet
Every system is perfectly designed to get the results it gets
W. Edwards Deming
Jeg anbefaler her fx at tjekke EmCrits gennemgang af nogle af disse problemer. Dette er et enormt “hot topic” lige nu fordi vi ser verdens tiltagende polarisering, formentligt katalyseret stærkt af ekkokamrene produceret af de stærkt penge-drevne social-medie algoritme (“you are the product”-mindset). Igen skal det pointeres, at dette ikke er ondskab. Folk vil oftest det godt for hinanden. Men lige nu ser vi den modsatte side som forfærdelige- og “disgusting”, i stedet for som en vigtig ying-yang-sparings partner, som sørger for at vi selv-reflekterer og ikke kører for langt ud i vores egen afgrund. Jeg anbefaler alle at se mindst en af Jonathan Haidts videoer eller podcasts, for at forstå disse argumenter tydligere. Menneskeracens overlevelse- og vores alles velvære virker efterhånden mere og mere til at afhænge af, at vi forstår det. En god indgang kan fx være denne
Sam Harris podcast with Joanathan Haidt, 2020: https://samharris.org/podcasts/204-may-18-2020/
eller har du ikke 60 min, så hér
Vi kan pege fingre nok så meget af medico-industrielle-komplekset og politikere m.m, men i sidste ende må vi for at gå igennem en ordentlig og saglig diskussion om hvad der er bedst for patinenten, kigge os selv dybt i øjnene. Både os som specialister, men i det hele taget lægefaget som helhed, og det vi ønsker at være i samfundet. Bør vi eksistere i nuværende form, eller er vi bare overflødige?
There are […] conflicts [of interests] from physicians / everyone involved in healthcare . It can be really hard to disentangle from the fact that we are specialists (that we have some reason of existence) and our reasons of existence may be related to doing some particular procedures or doing some type of medicine that may be threatened by evidence . How likely is it that we will design studies that will show that what we do is something that needs to be abandoned [fx trombolyse på vide indiaktioner og liberal PCI for CAD], that we need to change jobs , that we are not relevant , not needed in order for people to have better health. I think that adds another layer of conflict that is very difficult to disentangle
John Ioaniddis, The recommended dose podcast, 2019
Hvad ville sige, hvis hele dit kliniske felt (fx trombolyse overlæge, eller PCI-specialist) fra den ene dag til den anden pludselig blev fundet ubrugbart? Følger vi, som vi hævder, idealet om at patientens interessemål skal komme over vores egne, bør svaret være enkelt. Men noget siger mig, at det ikke forfalder sådan
Jerome Hoffman plejer ofte at quote Upton Sinclair:
It is difficult to get a man to understand something when his salary depends upon his not understanding it
Upton Sinclair
Dette gælder for både farma, politikere, læger og patientorganisationer m.fl.
Personligt mener jeg, at der i moderne medicin (ikke nødvendigvis specifikt i Danmark) ligges for stor vægt på hospitals-medicin og for lidt fokus og ressoucer på primær- og sekundær prævention, og på “care” (alt det, der er umåleligt, men som er essensen af medicin). Dette er ikke kontroversielt, men vi bør overveje nærmere næste gang vi presser vores politikere fra vores eget speciale og ønsker at indføre en ny revolutionerende behandling, som kræver store mængder penge for en relativt lille del af befolkningen kan have en NNT på 20 (udvikling kan stadig ske uden den slags)
Medical care is not the sole, or even the most important, determinant of health outcomes. Social determinants—including, but not limited to, food insecurity, homelessness and addiction—are profoundly important to the health of a great many patients. These issues must be addressed as part of the larger healthcare system, but it is also critical that ED clinicians pay attention to and address social factors in their patients, individual by individual.
Dorsett og Hoffman et al, 2019: Bringing value, balance and humanity to the emergency department: The Right Care Top 10 for emergency medicine
Vi kan nok ikke forvente altruisme på alle fronter, og af den grund er vi for vores alles bedste, nok nødt til at designe systemet, så det er lettere at træffe de rigtige valg. Vi er nødt til at skabe kulturer, hvor “sandheden” kan vokse frem (se Jonathan Haidt herover, eller The Culture Code af Daniel Coyle). Vi er nødt til at (gen)lære ydmyghed, og forstå vigtigheden af medicins “thelos” (fra aristoteles: essens) ikke kun er teknologi, men ligeså meget “compassionate care” (hjertet), og vi er nødt til at grænske vores informations økosystem, så det ikke er unødigt kontamineret med de nuværende bias, der gør “signalet” så svært at finde. Vi skal blive mere restriktive og selektive om, hvad vi måler (fx 4 timers regler etc), og hvor tungt de “mål” skal veje ift det umålbare, så det umålbare ikke “kvases” (se fx Don Berwick, der hentyder til nogle af disse principper som “the 3rd era of healthcare”)
You have to see people not as individuals seeking information but as social creatures , inmeshed in games of competition / war / conflict . When the conflict level is low and you put us in the right circumstances and institutions , we actually can find the truth (that’s the magic [thelos] of university and of science ). But imagine a scientific field in which suddenly – you take all the normal dynamics of science – and then you put a lot of money in, so there’s a huge amount of money riding on whether you get this discovery or patent . That would corrupt things and of course that has happened to some degree in medicine …
… in my field of psychology we’ve had this replication crisis[…]now we’re finding that even a lot of our experiments don’t replicate (not just observations as were previously thought). And so I think that the attitude we have to take into the 2020s is a lot more humility. We simply don’t know what the truth is, no matter how fervently we believe we do
Jonathan Haidt, podcast med Sam Harris (link herover)*-
Dr Ioannidis har lagt nogle løsningsforslag frem i sine artikler (se fx medical misinformation mess artiklen) og recommended dose-podcasten. Disse er system-niveau / research-løsninger
- 1: We need evidence to be aligned with what really matters (useful research / research that can make a difference )
- 2: there needs to be a problem rather than creating a problem (very often we are creating problems that don’t exist by shifting the definition of disease (creep) and making people seem sick when they are perfectly fine)
- 3: we need to see what we already know and build on that (se fx Anand Senthis EBM 2.0 og Ben Goldacres All Trials movement og Jeanne Lenzers bog: The danger within us) – regulationen af systemet skal granskes betydeligt (herunder FDA og EMA og hvem der betaler dem og hvilke interessekonflikter de har)
- 4: we need studies that will give us information (information gain – modsat “me again” studier, eller andre nyttesløse studier, hvor man ikke har lavet ordentlig forskning i “pre-test sandsynligheden” og hvordan dette studie bidrager til den samlede pulje af evidens)
- 5: remove conflicts of interests (Formentlig umuligt, men mitigere og designe vores område, så vi er transparente og kan fortolke ud fra denne transparens)
- 6: the value of investment of getting that evidence (i.e lige nu designer vi systemet for at der skal produceres en masse overflødigt bras – vi burde give helt andre incentives fx fokusere på kvalitet i stedet for kvantitet , lad kvalitet af studiet belønnes – ikke resultatet).
- 7: we need to be pragmatic (i stedet for at arbejde med studier som ikke kan ekstern valideres fordi de ikke baseres på vores patientgruppe, vores land eller endda bare udenfor det “laboratoriet”)
- 8: we need to listen to patients and what their priorities are rather than our priorities are (se del 2)
- 9: we need to protect ourselves from optimism / futility and designing Tower of Babel kind of studies that go nowhere and need to be abandoned or have studies that are biased
Vinay Prasad og Adam Cifu tilægger i sin bog Medical Reversal (Se quote herunder for detaljer). Disse ideer er bl.a Iona Heath, Jerome Hoffman og Anand Senthi formentlig også overens om
- 10: Lægestudiet bør stile efter at være meget mere pragmatisk ift den kliniske hverdag som lægen møder og forberede den studerende til kritisk tankegang, decision making, kommunikation, “tolerating uncertainty” m.m – desuden bør den “reduktionistiske” tilgang (se herunder) blive opvejet af empirisme
- 11: Kulturen i research skal omfavne “reproduktions”-research i stedet for at forkaste det som skammeligt. I stedet skal “novelty”-research, som i dag belønnes, fortsat prioriteres, men skal altid have reproduktions-elementer med!
- 12: Forstå at det redutionistiske paradigme (“…but it makes sense physiologically”), er hypotese genererende, men skal næsten altid testes ved studier
When we talk about how therapies work, we are talking about the basic sciences. We are talking about the mechanisms of how things work. In the scientific tradition, there are two complementary schools of thought, reductionism and empiricism. Reductionists believe that the more we understand about the mechanism by which disease happens and therapies act, the closer we are to optimally targeting therapy and curing disease. Empiricists are concerned foremost with whether interventions work. Why should you give a drug in the angiotensin-converting enzyme class to a patient with heart failure? Because it prevents ventricular remodeling. The empiricists would answer, because multiple RCT’s show that it improves outcomes. The views are complementary. You have to be a reductionist to have a good understanding of biology and to drive medical innovation. But in the end it is the empiricist whose answer is correct. However historically, the reductionist approach has always had priority in medical education
Prasad og Cifu, Medical Reversal
This is unrealistically optimistic. Whether the mechanism for a therapy is the mechanism of lung inflation or the tiny binding pocket of a renegade protein, you still need a trial to ensure that what you are doing actually accomplishes the ends [outcomes] you envision. The rumors of empiricism’s demise have been greatly exaggerated
The seduction of physiology (reductionism), Slutsky et al: …doctors like interventions that cause improvements in vital measures like bloodpressure or oxygenation. We know these numbers are important, are objective and correspond to improvements in physiology that we understand. It is reasonable to assume that if we can improve these measures in critically ill patients, we can improve survival. Therein lies the false seduction of physiology. Many times we have found that interventions that improve these measures do nothing to improve the survival of the patient. Improving physiological measures is comforting, but it does not always affect outcomes. None of this is to say that paying attention to physiology or designing therapies that improve physiological measures is worthless – it is not. But any such intervention must be rigorously tested, rather than blindly followed.
Tomorrows doctors probably needs to master three areas while in medical school: the doctor-patient relationship, system-based practice and practice-based learning
It is not hard to see that the years spent studying how the body’s small parts work may actually be harmful. These classes indoctrinate students with a belief in the primacy of the foundational medical science over the clinical one…we currently train students to be reductionists rather than empiricists. Students come to believe that a medical therapy works because of its mechanism. This is not an absolute truth. The mechanism is one way a therapy might work [i.e placebo, bio-psycho-social, complexity]. If the same model explains future data, then it is probably the way this therapy does work. One can only be certain that a given therapy actually works when the therapy is shown to work in RCT’s
Det er et uddannelsesproblem […]sundhedsuddannelserne har det største ansvar her. Det er dem , der ikke klæder læger, sygeplejersker , fysioterapeuter og jordemødre ordentligt på til virkelighedens patienter , som er meget potentielt sårbare og de er overhoved ikke på noget tidpunkt i uddannelsen blevet konfronteret med deres egen sårbarhed […] det store problem er at sundhedsuddanelserne er simpelthen ikke skruet sammen til virkelighedens patienter
Morten Sodemann, podcast med Line Gade 2017
Mange af disse løsninger er lidt som “løsningen” til global opvarmning. Det er enormt svært at få store komplekse systemer ændret, uanset hvor vigtige arguementer der findes for at gøre det.
Jeg har dog i del 2 ét løsningsforslag som du kan udføre i morgen, og gøre en kæmpe forskel ift din patients NNT, NNH samt dine diagnostiske evner og din egen velvære, samt risiko for at blive anmeldt til patienklagenævnet m.m: Compassionate Care og kommunikation

