I denne del vil to emner gennemgås: hypertension og nyresvsigt.
Hypertension
- Antihypertensiva generelt
- Korrelation og kausalitet
- Pseudodiagnoser
- Blodtryksmåling på akutmodtagelsen
- Overdiagnostik og hypertension
- Hypertensive kriser og akut hypertension
- Patienten med ortostatisme
Nyresvigt (AKI)
- AKI
- Kontrastinduceret nefropati – en myte?
Antihypertensiva og hypertension
Kausalitet og korrelation

Blodtryk (hypertension) er et emne, som vi konfronteres med dagligt som læger, og i min mening, er der megen forvirring omkring det både fra patienters side, men til tider også fra lægers side. Jeg (Peter) vil prøve at dykke lidt dybere ind i emnet. Mit standpunkt er, at antihypertensiva er enormt vigtigt til den rigtige patient. Men at finde denne patient, går vi ofte fejl – særligt på akutmodtagelsen:
Kausalitet eller korrelation? Et af de underliggende grundproblemer, der skaber forvirring med blodtryk, er konceptet om “bare fordi du kan måle det, betyder det ikke, det er årsagen til dine symptomer”.
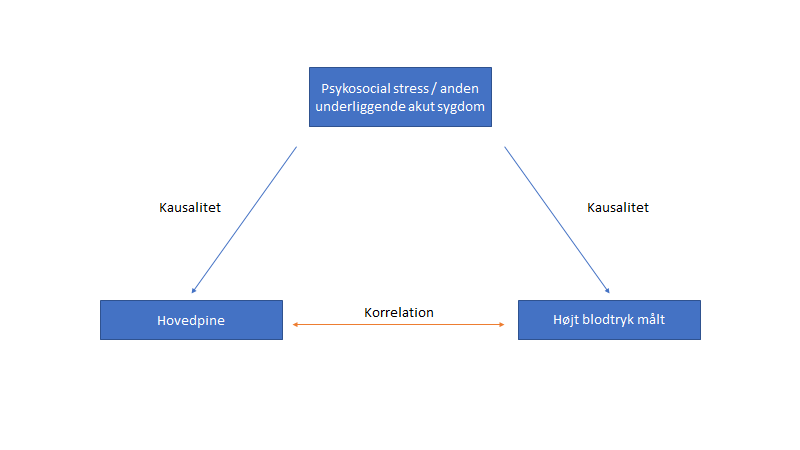
Forskellen mellem korrelation (Når to ting – fx højt målt blodtryk og symptomer som hovedpine – forefindes samtidigt, men ikke nødvendigvis forårsager hinanden. Ofte er der tale om en fælles underliggende årsag, der får begge ting til at opstå fx stress, angst eller sygdom) og kausalitet (Når den ene ting forårsager den anden – fx blodtrykket giver symptomerne). I min mening, er meget af det, vi (og patienten) tror er kausalt ift symptomer og blodtryk, i virkeligheden bare to ting, der sameksisterer.
Risikoen ved at se noget som kausalt i stedet for blot korreleret, er at vi udfører premature closure og potentielt kan gøre patienten iatrogent sygere (medicalization eller somatisering) end når de kom ind pga angst, og evt fejlagtig medicinering. Derudover er vi i risiko for at misse, hvad der egentlig var deres underliggende problem. Husk, som jeg tidligere har nævnt – behandling for en pseudodiagnose, kan give patienten to slags udfald: i bedste fald ingen forskel, og i værste fald bivirkninger.
After preliminary introductions when encountering a new patient, the doctor is taught to focus on the chief complaint, namely, what brings the patient to the doctor. Unfortunately the chief complaint may not be what bothers the patient and may have little to do with the underlying problem
I am persuaded that a majority of prescriptions intended to alleviate chief complaints are largely irrelevant. This may be a reason so many prescribed drugs prove ineffectual and is no doubt a major factor in medical costs. A patient with an unaddressed problem keeps searching for an answer and goes medicine-shopping. The many drugs prescribed for chief complaints often cause side-effects. In desperation patients acquiesce to costly and invasive procedures
Bernard Lown, The Lost Art Of Healing, s. 12 og s 14
We often have to make sense of highly uncertain situations, but uncertainty isn’t always reduced by gathering more and more information. Sensemaking is not just a matter of connecting the dots. Sensemaking determines what counts as a dot
Gary Klein, Streetlights and Shadows
Blodtryksapparatet anvendt som “skal jeg gå til lægen”-test, og pseudodiagnoser
Mange patienter anvender deres blodtryk apparat hjemme som en slags screening for om de skal gå til læge eller ej. Det går ofte således: Patienten har et nyt symptom (fx hovedpine, brystsmerter, hjertebanken) -> patienten bliver urolig og pga mangel på krystalkugle og tarokkort, søges i stedet ved pseudo-science alteret der er købt på apoteket i god tro: BT apparatet, der som vinden blæser enten viser lavt blodtryk (falsk negativt? sandt negativt?) eller højt (sandt positivt? falsk positivt?), hvis man ikke anvender det systematisk med regelmæssige punktlige målinger. Alt efter hvad denne moderne krystalkugle viser, vil patienten søge læge eller også ikke. Arbejder du i Sverige, som jeg gør, betyder det, at du ser mange af de her patienter på akutmodtagelsen. Arbejder du i Danmark – kun hvis de ringer 112, eller hvis du er almen praksis.
Vi læger har desværre en tendens til at give patienten ret (eller har ikke tid / lyst til at sige dem imod). Ofte tilskriver vi patientens symptomer en slags pseudodiagnose i form af fx hypertensionsrelateret hovedpine (når vi stedet ærligt skulle sige, at vi biologisk set ikke kan forklare patientens symptomer, og nok bør forklare det empatisk med psyko-sociale (del)faktorer).
Doctors experience intense discomfort when forced to admit that they don’t know what is going on. A common ploy is to designate a condition with a meaningless diagnosis promoting the thought that they know exactly what is the matter
Bernard Lown, The Lost Art Of Healing, s. 50
Dette skal skelnes fra de veldefinerede kliniske syndromer, som hypertension kan afstedkomme.
Blodtryksmålingen på akutmodtagelsen
Patienten er ofte urolig over sit blodtryk, og hvorvidt det korrelerer med diagnosen “hypertension”
Jeg plejer at forklare patienten, at blodtrykket taget på akutmodtagelsen tages for en helt anden grund (Ofte som led i triagering, hvor BT blot er en pusselsspilsbrik i spørgsmålet: har patienten en tidskritisk tilstand) end at diagnosticere hypertension og repræsenterer kun i ringe grad deres egentlig blodtryk.
Korrelationen mellem målt blodtryk på denne, deres “værste dag” på akutmodtagelsen, taget siddende i en seng imens de snakker og lige har været oppegående, i deres nervøsitet over udredningen, med en one-size fits all manchet, og diagnosen “hypertension” – hvor repræsentativ tror vi egentligt det er for “gennemsnitsblodtrykket”?
Ikke destomindre nævnes dog i EmCases Ep 40
“For patients who present at triage with a high BP, an elevated second measurement one hour later correlates highly with actual outpatient hypertension, and does not correlate with the patient’s anxiety and/or pain”
Derfor kan man godt sende patienten til follow-up ved egen læge, hvis man har målt flere på hinanden høje blodtryk på akutmodtagelsen, og opstart af behandling kan retfærdiggøres – omend mener jeg fortsat, dette bør gøres ved forsigtighed (start low, go slow), særligt ved ældre, da regelmæssige målinger må til før man kan stille en regelret diagnose (og ikke giver dem en ofte mere alvorlig faldtendens ved at sænke deres dal-værdi i blodtrykket)
Tvinges vi til at opstarte antihypertensiva findes 4 ligeværdige mediciner (dansk hypertensions selslab og ESC)
- Thiazider med kalium – fx centyl mite (biv: kræver eGFR >30)
- Calcium antagonister – fx amlodipin (biv: deklive ødemer)
- ACE-hæmmere – fx enalapril (biv: tør hoste, skal følge kreatinin ved opstart, CAVE NSAID og kombiner ikke med angiotensin II antagonister – sjældnere: angioødem; velegnet ved nyreproblemer og kronisk hjertesvigt)
- Angiotensin II antagonister – fx losartan (biv: hyperkaliæmi, nyrepåvirkning)
Har patienten dog hjertesvigt, arytmi eller anden betablokade-behøvende hjertesygdom er betablokkere ofte førstevalg. Ved hjertesvigt overvejes desuden spironolacton eller eplerenon.
Overdiagnostik og hypertension
Det følgende er kontroversielt, så tag det med et gran salt eller to. Jeg mener dog det er en ekstremt vigtig debat – ikke blot for hypertension, men for al slags medicin vi praktiserer:
Få beskriver dette emne bedre, end Iona Heaeth fx i denne video
Konceptet er et generelt koncept i medicin, som sammenfattes ganske godt via nedenforstående graf (modificeret fra denne læsværdige post den skotske akutmedicinske blog St Mungo’s: Not Everything that Counts Can Be Counted):
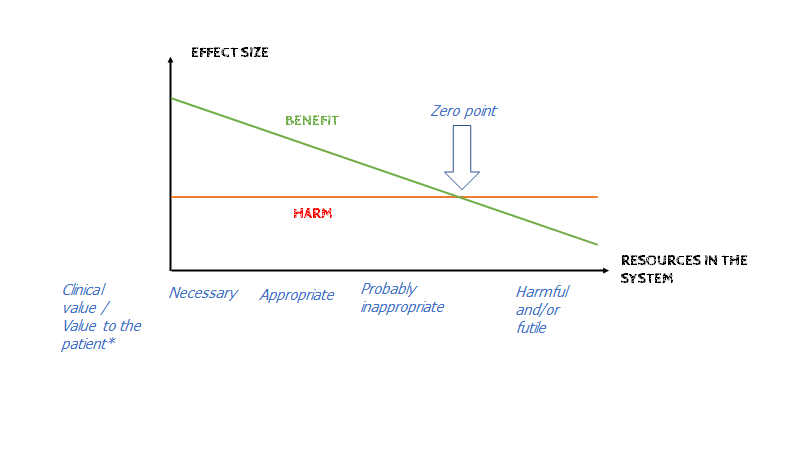
This graph shows us that for any treatment the rate of harms or side-effects are fairly constant. For those who have a clear indication for treatment, if it is effective, benefits outweigh potential harms. With greater resource we offer the treatment to more people [red: fx pga indication creep, uncertainty, risk proximity m.m]. Indications may be weaker and the treatment may have less effect … but rates of harm remain constant. At some point, all we are doing is exposing patients to harm with no added benefit
Not Everything that Counts can be Counted, St Mungo’s blog, 2018 – https://stmungos-ed.com/blog/noteverythingthatcounts
Vi ønsker med vores medicin at give den bedste benefit:harms ratio til den individuelle patient foran os med vores behandling. Harms er næsten altid konstant uanset om du behandler meget syge, eller ikke-syge, hvorimod benefit varierer alt efter graden af sygdom (og om de har sygdom overhoved) – der findes undtagelser til denne regel: fx stroke og trombolyse, hvor tromboylsering af raske ikke har samme grad af risiko for harms (blødning), som ved syge. Men generelt gælder: Jo sygere / tydeligere symptomer, des bedre benefit-harm ratio. Efterhånden som der kommer flere ressourcer i systemet (således at “tests” som blodprøver, BT måling, screeninger etc) vil harm:benefit ratioen falde for den individuelle patient til et punkt, hvor det vi gør, faktisk begynder at skade patienten. Jeg har tidligere talt om overdiagnostik (fx i denne blog), som dette kan kategoriseres under. Jeg vil i stedet nævne et relateret begreb: “indikation creep”. Indication creep er kort sagt, når vi har studeret en meget syg population (eller en population på et meget specialiseret sted, fx ITA eller en kardiologisk afdeling), og ekstrapolerer studiets resultat til en mindre syg population. Et klassiskt eksempel, er anvendelse at trombolyse er godkendt til patienter med klinisk mistanke om stroke og moderat-høj NIHSS. Mange steder vil man dog trombolysere patienter med lavere NIHSS (<5), trods at vi ingen studier har.
Dette forsvares ofte ud fra “det fysiologiske argument” (hvis det giver mening fysiologisk hos en type af patient, må det også give mening hos den mindre syge) / reduktionisme
…doctors like interventions that cause improvements in vital measures like bloodpressure or oxygenation. We know these numbers are important, are objective and correspond to improvements in physiology that we understand. It is reasonable to assume that if we can improve these measures in critically ill patients, we can improve survival. Therein lies the false seduction of physiology. Many times we have found that interventions that improve these measures do nothing to improve the survival of the patient. Improving physiological measures is comforting, but it does not always affect outcomes. None of this is to say that paying attention to physiology or designing therapies that improve physiological measures is worthless – it is not. But any such intervention must be rigorously tested, rather than blindly followed
Prasad og Cifu, 2016: Medical Reversal
Når man dog laver formelle studier på den mindre syge population fremkommer den dårlige risk:benefit-ratio – i NIHSS tilfældet viser det eneste randomiserede studie, at det faktisk er harm > benefit (se PRISM studiet via REBEL EM)
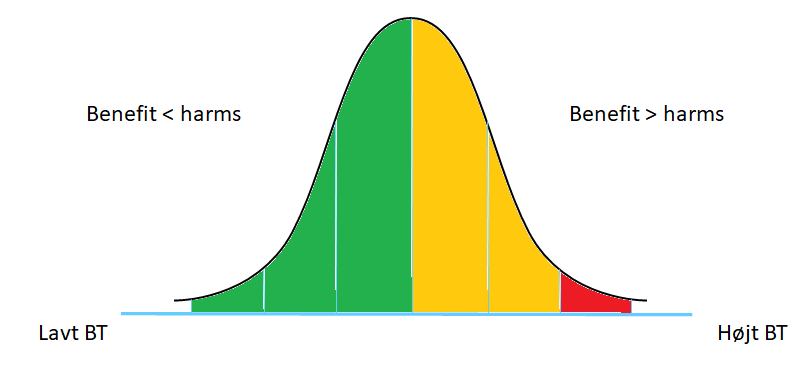
Det samme sker ved hypertension (jf Iona Heaths lektur herover), og alle andre tilstande vi behandler. En anden måde at se dette på, er ved en Bells Kurve / normal fordeling. De der har størst fordel ved behandling (størst benefit:harm ratio), er dem i ekstremen af højt BT. Som leder af Lown institute, Vikas Saini pointerer (30:00-36:00), så sker majoriteten af AKS og strokes desværre i midten af denne bells kurve (altså for folk uden- eller med mild hypertension). Problemet som, jeg forhåbentligt har illustreret i grafen herover, ved at behandle “alle” med mild hypertension for potentielt at forhindre fx stroke og AKS er, at risk-benefit ratioen er helt anderledes, når vi taler “mild hypertension”. Vi er med andre ord meget nærmere “zero-pointet” på grafen herover
Skal vi behandle mild hypertension, mild hypercholesterolinæmi, mild hyperglykæmi etc, så skal patienten under alle omstændigheder tydeligt informeres (shared decision making). Man kan tilføje en ekstra dimension på bells kurven (her illustreret ved en y-akse). Den ekstra dimension er patientens “risk aversiveness” for en given hypertensions-risiko. Dette er “patient-value”-elementet af evidens-baseret-medicin triaden
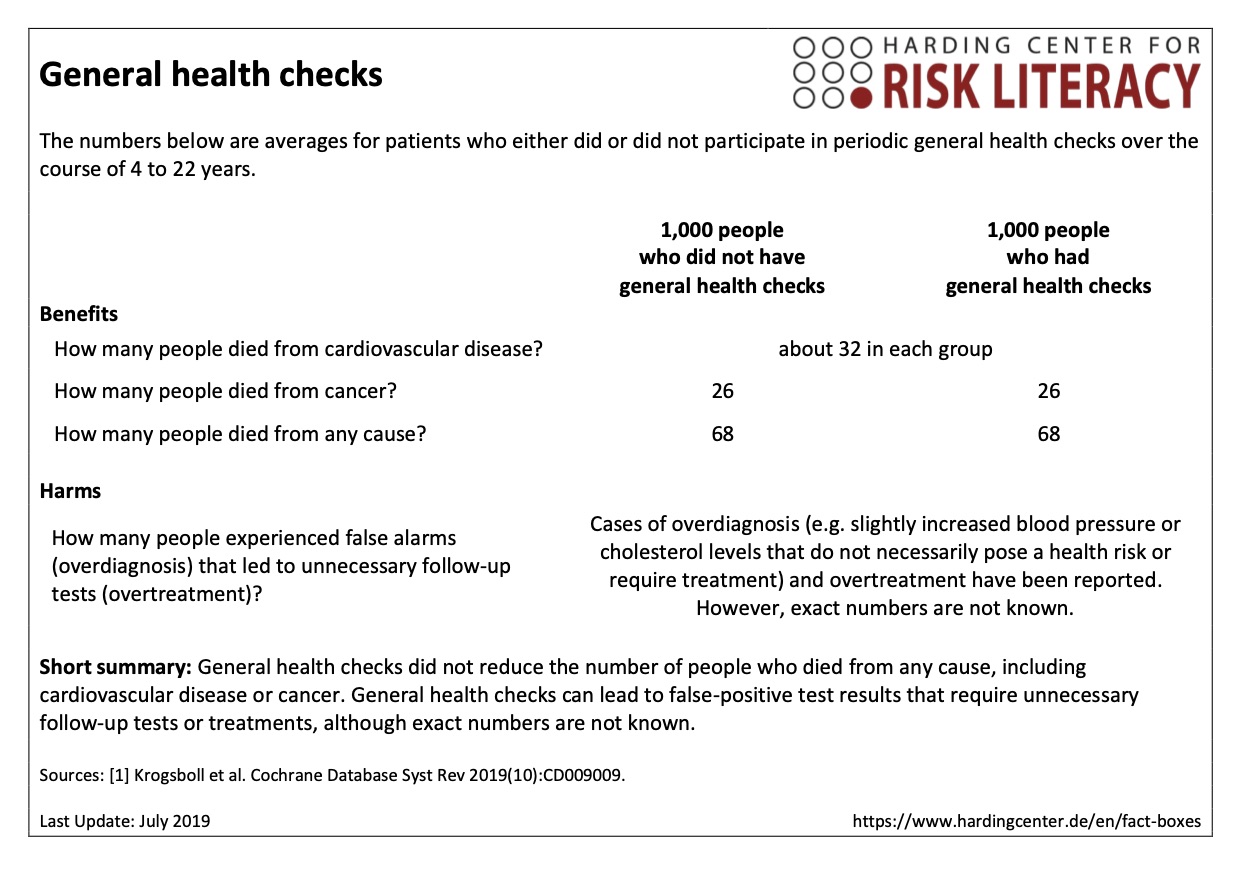
Hardinger center har forslag på, hvordan vi bedst muligt kan informere patienter om disse low-yield behandlinger. Her blot et eksempel:
Overdiagnostik = Underdiagnostik
Som Iona Heath ofte påpeger i sine lekturer om overdiagnostik: Det værste ved overdiagnostik er ikke engang skaden vi iatrogent påfører patienten. Det er konceptet om “opportunity cost” (at vælge en ting, fravælger andre ting): Det er den uundgåelige underdiagnostik, der går hånd i hånd med overdiagnostik. Når vi vælger at fokusere ressourcerne på screeningsprogrammer, guidelines om osteoporose, hypertension m.m, så må vi automatisk fravælge andre områder – disse områder er ofte områder der behøver ressourcerne mere. En ekstrem analogi til dette, er billedet af vestens overvægt, imens de der behøver mad mest, sulter.
Vil vi fokusere påcen effektiv måde at mindske hypertension på, bør vi fokusere på at gøre det muligt i vores arbjedskultur at få tid til træning, sund mad og psykologisk velvære (altså primær prævention) – og fokusere mindre på det, der giver mindst afkast; altså at behandle minotiøse forskelle i blodtryk hos patienter med mild hypertension, hos i øvrigt raske individer.
Hypertensive kriser og akut hypertension
Hypertensive kriser
Overstående hypertension skal stærkt skelnes fra patienter med akut og farlig hypertension (som enten viser sig ved påfaldende symptomatologi eller persisterende blodtryk >220 systolisk):
- PRES
- Præ-eclampsi / HELLP syndrom
- Metabole årsager / endokrinologiske kriser fx Phæokromocytom
- Malign hypertension / Hypertensiv encephalopati
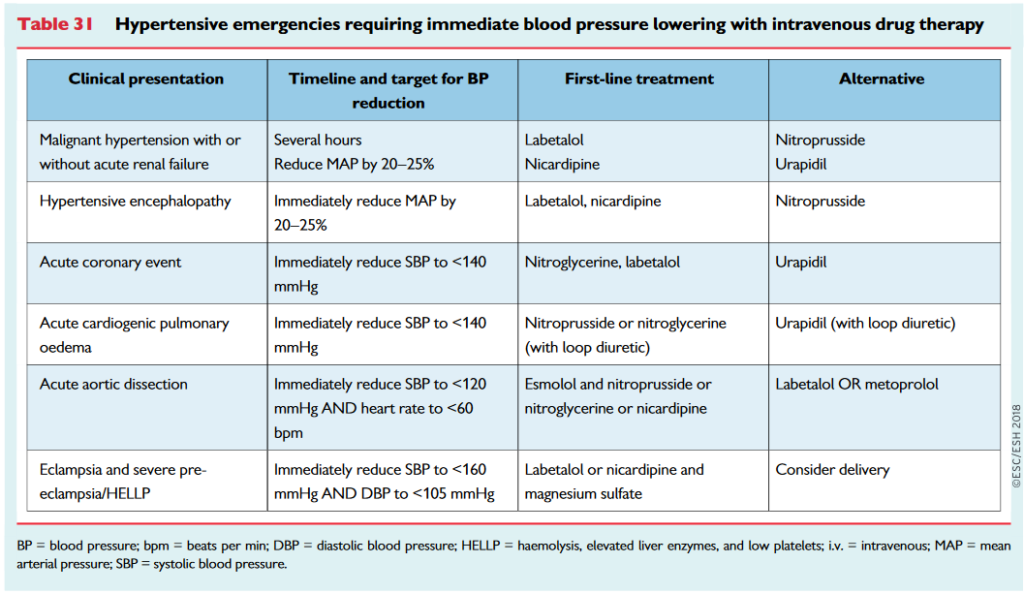
Udenfor disse veldefinerede- og i min erfaring (og litteraturen) tydeligt hypertensions-relateret syge patienter, er tilskrivelsen af symptomer (hovedpine, træthed, hjertebanken etc) som følge af hypertension ud fra hvad jeg kan researche mig til, yderst tvivlsom.
Pas på pseudodiagnoser: Om hovedpine og svimmelhed kan komme af højt BT er tvivlsomt. I min erfaring vil jeg gå så langt at kalde BT-relaterede symptomer (udenfor overstående særlige syndromer, som ofte har signifikant højt blodtryk >220 systolisk), for “pseudo-diagnoser”. Risikoen ved at stille en “pseudodiagnose”, er at undlade at forklare patienten om
- 1) psyko-sociale forhold og problemet med at anvende blodtryksapparatet som en test for syg/ikke syg (som mange patienter gør)
- 2) inducerer anchoring, og misser til tider farlige tidskritiske diagnoser
Så mit råd er, at glemme “hypertensions-induceret hovedpine” eller andre symptomer patienten tror er hypertensions-induceret, og i stedet tale om bio-psyko-social modellen i stedet, med hypertension som en delkomponent (hvis den overhoved skal med) – se også “smerte”-delen herunder. Hvorfor tager patienten hjemme-BT? Fordi de ønsker en let test der kan afgøre om de er syge eller ikke. Hvad ligger bag dette? ofte en helbredsangst / uro (som vi alle kan have) som aldrig berøres, hvis man stryger patienten med hårene og bekræfter dem i, at deres symptomer må være blodtryksrelateret. Vi bliver nødt til at lytte
Where a diagnosis cannot be clearly demonstrated with positive tests, doubt has room to grow. Where the mechanism of a illness is poorly understood, questions flourish. To a person struggling against the possibility of a psychological diagnosis, the unknowns create a hiding place”
Suzanne O’Sullivan, It’s all in your head, 2016
Obs: dette betyder ikke, at du ikke skal behandle patientens hypertension, hvis det er målt korrekt (som udgangspunkt = gennemsnitsblodtryksmålinger i hjemmet). Men hypertensionsdiagnosen og symptomerne de præsenterer med på akutmodtagelsen, er sjældent kausale!
Akut hypertension
Case: 50 årig frisk mand, BMI ca 30, præsenterer på akutmodtagelsen efter henvisning fra øjenafdeling med positive synsfænomener i venstre synsfelt som varede i 30 minutter. Nu er alt godt. Ingen hovedpine, lys/lydskyhed, nakkerygstivhed eller neurologiske fokale symptomer i øvrigt. Øjenafdelingen sendte ham til jer, fordi de målte et BT på 220/120 . I Triagen BT 230/120, øvrige vitalparametre er upåfaldende. Patienten er helt upåvirket, og vil hjem til sin hund. Ingen migræne tidligere. Ingen migræne i familien.
Havde patienten ikke haft synssymptomer med hypertensionen ville man kunne have betragtet hans hypertension som en screeningstest i en lav-risiko population (i.e – han havde nok gået rundt med det længe, og en man kunne sende patienten hjem med opfølgning via egen læge efter sikring af intakt organfunktion med EKG, nyrefunktionsprøver og urin-stix. Var man meget grundig kunne man have taget basal udredning for sekundær hypertension for at påskynne processen lidt).
På grund af hans fokale neurologiske symptomer samtidig med svær hypertension, var risikoen efter min mening høj nok for en af de sjældnere årsager til at nogen slags udvidet test måtte laves for at reducere denne risiko. Historien tydede ikke på fæokromocytom (ikke episodisk), TCI var en mulighed men med atypisk præsentation med positive synsfænomener. Intrakraniel tumor eller PRES virkede som de mere sandsynlige af de farlige årsager). Skal vi sænke blodtrykket først, eller i skanneren først? Hvordan skal blodtrykket sænkes?
Akut sænkning af blodtrykket: Ved trombolyse af stroke patienter, ICH, SAH , aortadissektion, højtryks hjertesvigt / lungeødem og overstående sygdomme (PRES, fæokromocytom, hypertensiv encephalopati m.m) med alvorlig hypertension, kan blodtrykket sænkes hurtigt. Følgende har vi i værktøjskassen
- alfa/betablokkere – Trandate (kan fx gives i bolus 25-50 mg langsomt – siden kontrol BT og refrakte doser til effekt): God til stroke ved trombolyse (mål <180 / 100 systolisk), ICH (kontroversielt, men <140-160 systolisk), SAH (<160 systolisk), Aortadissektion, og de fleste andre hypertensive kriser. Næsten uden undtagelse er trandate førstevalget
- NO-donorer (nitro) – anvendes primært til lungeødem (i kombination med furix)
- Calciumantagonister – fx amlodipin eller meget hurtig virkende mediciner som nifedipine
Er smerte og respirationsbesvær en del af årsagen, sænkes blodtrykket også ved behandling af disse elementer (Fx med morfin)
Er kvalme og opkastninger en del af det, kan man med fordel behandle disse også med antiemetika (jf del 3)

Case fortsat: Jeg valgte sammen med min bagvagt, at behandle patienten med amlodipin eftersom han ikke var encephalopatisk og bedømtes ikke i akut behov for IV anti-hypertensiva pga fravær af alvorlige komplikationer. Vi udførte en hurtig CT skanning for at udelukke ICH eller stor intrakraniel tumor. PRES og mindre tumorer kan ikke udelukkes på en CT skanning, hvorfor patienten blev indlagt til observation i trombyl dække indtil TCI kunne gøres mindre sandsynlig ved udredning og grundigere historie. En MR skanning dagen efter viste et hypofyseadenom, og cushings syndrom blev patientens diagnose.
Bottom line: Svær hypertension + et alvorlig symptom (graviditet, dyspnø, personlighedsændring eller komatøs tilstand, eller fokale neurologiske udfald), skal føre til videre udredning og hurtig sænkning af blodtrykket. Alt som ikke falder indenfor denne kategori, kan udredes via egen læge, evt med screening for kronisk organskade (nyre og hjerte) på akutmodtagelsen i udvalgte tilfælde.
Patienten med ortostatisme
Medmindre patienten er så ekstremt ortostatisk, at han ikke kan sidde op uden god grund (obs shock), er ortostatisme ikke en tidskritisk tilstand. Vi støder dog ofte ortostatisme i forbindelse med den ældre patient med TLOC (transient loss of consciousness) eller ANS dysfunktion pga fx parkinson eller diabetisk polyneuropati. Giver det mening at måle ortostatisk blodtryk på akutmodtagelsen (eller overhoved)?
“There has never been strong evidence to support orthostatic vital signs. If you test a random sample of asymptomatic, healthy, elderly patients, you will find abnormal results in a large number. (In other words, orthostatics aren’t very specific.) For example, Raiha (1995) looked at a random sample of well elderly patients, and found orthostatic changes in 28%, with no association with 10 year outcomes. Ooi (1997) looked at 911 asymptomatic nursing home patients, and found orthostatic hypotension in more than half. Similar results have been seen in adolescent patients (Steart 2002)”
https://first10em.com/orthostatic-vital-signs-dont-help/
Så ortostatisk blodtryksmåling på akutmodtagelsen (eller i det hele taget), er noget, som har lav evidens. Ortostatisk hypotension eksisterer dog stadig, og vi skal behandle patienter, som har symptomer, der taler for det – men indtil videre studier skulle tale for det, virker det ikke til at ortostatisk blodtryksmåling er vores tid værd (og særligt ikke i akutmodtagelsen).
Håndtering af ortostatisme: Ved patienten med høj risiko for fald og synkope som følge af ortostatisme (fx parkinsonpatienten / polyneuropati patienten med antihypertensiva uden støttestrømper), er det meget vigtigt, at vi optimerer hans / hendens anti-ortostati-behandling, ikke mindst pga en teoretisk risiko for hypoperfusions strokes (jf ESC 2018 guidelines for synkope)
- TED strømper (vigtigt!, og skal nævnes overfor patienten)
- Undgå / forebyg dehydrering (variet væskeindtag – tommelfinger-regel er at kigge på urinen, der skal være lys-gul. Hvis mørk-gul, så drikkes der for lidt. Kan patienten ikke dette, er 1,5 L/d formentlig et godt startpunkt, hvis ingen øvrig væskerestriktion fx hjertesvigt)
- Sov med hovedgærdet eleveret 45 grader
- Små protein-rige måltider flere gange om dagen hos den småtspisende (evt supplement med lakrids, saltstænger, chips og anden saltholdig mad)
- Evt medicinering for ortostatisme (flurinef etc)
- Reducering / Pausering af ortostati-inducerende medicin (jf fald-inducerende medicin i del 1)
Hvis du desuden har en patient med svær ortostatisme som ikke helt passer ind i deres øvrige patofysiologi, overvej da parkinson udredning via egen læge / neurolog
Pitfalls: mange af disse ortostatisme-patienter har ofte høje blodtryksmålinger (særligt nattetid). Et særligt problem ved denne gruppe er, at man ofte er fristet til at behandle deres høje blodtryksmålinger (som kan være meget høje), med det resultat, at deres dal-blodtryk over dagen rykkes nedad og inducerer fald.
Selve diagnostikken af disse patienter med ortostatisk blodtryksmåling ifb fx synkope er dog kontroversiel på akutmodtagelsen
Kilder
Hypotension ved shock og permissiv hypotension
En af de vigtigste årsager til at vi tager blodtryk på akutmodtagelsen, er at finde hypotension, som kunne betyde shock. Det vi ønsker at finde er ikke hypotension, men organ-hypoxi. Blodtrykket – isoleret set – er ikke den gode markør vi altid tror:
- Ældre og hypotension: ældre har ikke nødvendigvis hypotensive ved shock. Særligt fraile ældre kan præsentere atypisk. Har man hypertension, vil man i stedet skulle tale om “relativ hypotension”, således at en patient med gennemsnitsblodtryk på 170 / 100, allerede
- Se på patienten: For ofte i ABCDE scenarier fokuserer vi på det lave blodtryk (eller fraværen af det), og ser ikke på patienten. Sved-tendens, klamtsvedende etc, virker efterhånden til at være bedste måde at se om patienten er “syg” (se trauma EmCases)
Én metode som flere steder begynder at vinde ind, er den simple “shock index“, ift om patienten behøver “massive transfusion”.
En anden metode foreslås i EmCases Ep 118-119, at man måler antallet af “units” (ting fx 1 pose blod = 1 unit / 1 ting), man har givet over 60 minutter. Har man givet >4 units / ting, og stadig ingen væsentlig bedring på 60 min, så må man steppe up.
Når vi har behandlet patientens hypotension, hvordan måler vi så responsen? Der er mange gode råd, men ingen stor evidens.
Permissiv hypotension i traume og i øvrigt, er en hot potato af et emne, men formentlig kan vi være mere konservative end vi tidligere har troet. Undtagelsen er stadig hovedtraumer, men selv her begynder man at stille spørgsmål. Disse emner gennemgås bedst i følgende kilder, og jeg anbefalder, at har man interesse, at gå igennem disse
- EmCases Ep 118 + 119: The First and Last 15 Minutes Part 1 + 2
- Hicks et al, 2018: Resuscitation Resequenced A Rational Approach to Patients with Trauma in Shock
- EmCases Ep 101+102: Upper GI Bleed
- EmCases Ep 122: Sepsis and septic shock
Kilder for specifikke tilstande og antihypertensiv behandling
- Dansk hypertensions selskab: DAHS
- ESC 2018: Clinical Practice Guidelines for the management of arterial hypertension
- Cardio.dk -> https://www.nbv.cardio.dk/hypertension
- Parkinson (Neuro NBV)
- ICH (Neuro NBV)
- SAH (neuro NBV)
- First10Em Ortostatic vital signs don’t help
- EmCases EP 40 + 41: hypertension
- Simon Carley (youtube): can we teach clinical judgement
Akut kidney injury (AKI)
AKI defineret ud fra KDIGO (Kidney Disease Improving Global Outcome) og DNS (Dansk Nefrologisk Selskab) som en af følgende tre kriterier
- a) Stigning i p-krea >26,5 µmol / L over 48 timer
- b) Stigning på 50% eller mere indenfor 7 døgn fra udgangsværdi [af p-krea], der opfattes som patientens habituelle kreatinin niveau
- c) Urinproduktion trods relevant terapi på under 0,5 mL/kg/time gennem seneste 6 timer
Ifølge det engelske sundhedssystems taskforce for nyresygdom “ThinkKidneys”, har 1/5 patienter på akutmodtagelsen AKI, og 3/10 med AKI på hospitalet kan forhindres. For at forhindre det er vi nødt til at
- 1. Forebygge og screene risikogrupper for AKI
- 2. Anerkende AKI når det opstår på akutmodtagelsen (jf kriterierne for AKI herover) og
- 3. Handle på det
Dette er generelt et overset problem for patienterne, da det ikke er et symptomgivende problem, og man bør have AKI på enhver “ting jeg skal tjekke inden indlæggelse”-tjekliste. Bemærk, at patienten ikke behøver at have “røde” tal i sine blodprøver, for at have AKI ud fra overstående definition. For mere information anbefales
- KDIGO: lavet en struktureret guideline der også omhandler farmakologisk intervention ved AKI.
- DNS holdningspapir: Der er udarbejdet et informativt og struktureret holdningspapir fra Dansk Nefrologisk Selskab, der blandt andet indeholder et afsnit i punktform, over hvilke farmakologiske grupper man bør overveje at undgå.
- ThinkKidneys: NHS i England kommer via Thinkkidneys kampagnen også med en række rekommandationer i forhold til medicin og AKI.
Følgende flowchart er fra DNS holdningspapir som giver et overblik over håndteringen af AKI patienten, samt hvilke risikogrupper- og situationer man skal overveje profylaktisk behandling (pausere medicin, fokus på væske etc)

I tråd med ovenstående flowchart kan man overveje at revidere patientens medicinliste ved at undgå, nedtrappe eller muligvis seponere følgende lægemidler:
Lægemidler, der opkoncentreres ved særligt lav eGFR:
- NOAK / DOAK
- Morfin (varierer alt efter præparatvalg)
- Antiviral- og antimykotisk medicin
- Digoxin
- Lithium
- Diuretika (fx loop- og thiazid diuretika)
Lægemidler, der under særlige omstændigheder er nefrotoksiske (og bør pauseres ved AKI):
- ACE-hæmmere
- NSAID
- >1 dosis af gentamycin
- ARB-hæmmere
- Farlige kombinationer (NSAID + ACE-hæmmere / ARB hæmmere / Calcium)
Lægemidler der indvirker på kaliumkoncentrationen:
- Kaliumtilskud (kaleorid etc)
- Kaliumbesparende diuretika (fx spironolakton)
- Kaliumbesparende antihypertensiva
Så næste gang du gennemgår patientens medicinliste, så anvend en af følgende
- Seponeringslisten 2020 – https://www.sst.dk/-/media/Udgivelser/2019/Seponeringslisten-2020.ashx?la=da&hash=3E27830D475F39794290E7E50BDFEA208F02644E
- Thinkkidneys liste over nefrotoksiske- og opkoncentreringslægemidler: https://www.thinkkidneys.nhs.uk/aki/wp-content/uploads/sites/2/2016/03/Guidelines-for-Medicines-optimisation-in-patients-with-AKI-final.pdf
- Dansk nefrologisk selskabs holdningspapir eller KDIGO – http://nephrology.dk/wp-content/uploads/2016/12/DNS-AKI-Holdningspapir.pdf
Kontrastmiddel induceret AKI (en myte?)
“Kontrastundersøgelser bør om muligt undgås. Hvis kontrastundersøgelser er nødvendige, bør det sikres at patienten er velhydreret og modtager intravenøs væske”, skrives i holdningspapiret om AKI fra Dansk Nefrologisk Seslskab
Den samlede evidens på området er dog yderst tvivlsom for om kontrast-nefropati findes i den udstrækning som vi tror, og om det overhoved eksisterer, og ikke bare er udtryk for patienternes grundmorbus og selektions bias – jf fyldig gennemgang af litteraturen på Journal Jam 11 Post Contrast Acute Kidney Injury – PCAKI
Al gennemgået litteratur er observationelle studier og retrospektive studier. Endnu findes der ingen RCT’er på området, men formentlig er der ikke nødvenighed at lave dem
Efter gennemgang af litteraturen er EmCases konklusion
“There is no reliable evidence that Contrast Induced Nephropathy exists. Patients who you believe require a CT scan with IV contrast should get one regardless of their renal function. Our attention should shift away from the IV contrast and toward ensuring that ED patients at risk for AKI do not receive nephrotoxic medications, have their fluid status assessed and attended to, and are counselled appropriately regarding their risk of AKI in hospital“
EmCases Journal Jam 11 Post Contrast Acute Kidney Injury
I en nyligt udkommet konsensus mellem det amerikanske radiologiske selskab, og the kidney foundation nævnes derfor også: “The putative risk of administering modern intravenous iodinated contrast media in patients with reduced kidney function has been overstated. This is primarily because of the conflation of contrast-associated acute kidney injury (CA-AKI) with con-trast-induced acute kidney injury (CI-AKI) in uncontrolled studie”
Særligt ved cisplatin: Hvis patienten nogensinde har været cisplatin behandlet fx ved tidligere cancersygdom (fx lunge, urologiske, gynækologiske, og evt. som kombination med stråler ved øsophageus, anal og hoved/hals). Hos disse patienter bør man undgå gentamycin.