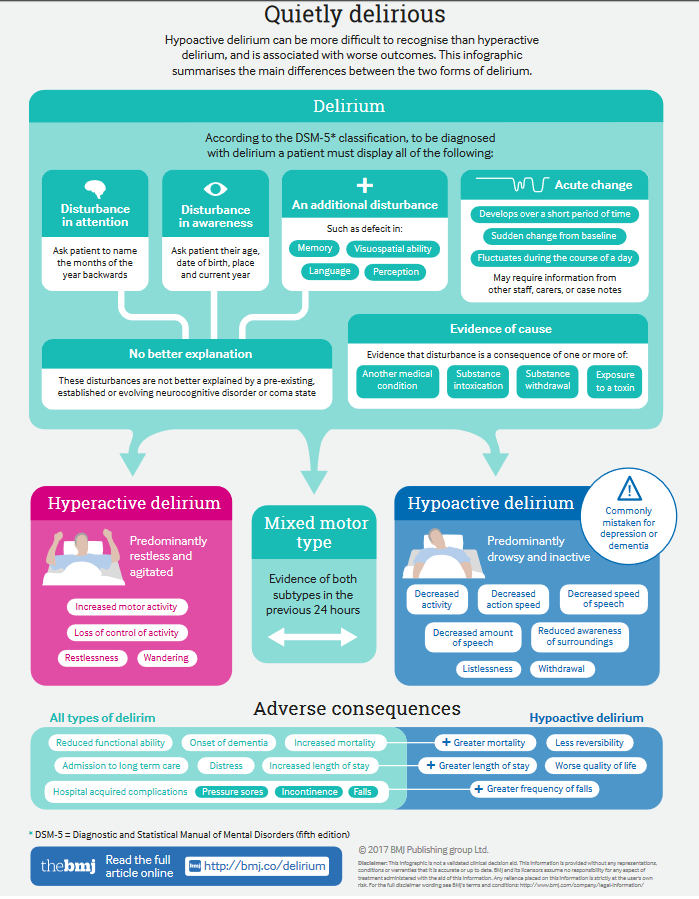
Polyfarmaci, antikolinerg load, compliance, medicingennemgang, delir og fald
Koncepter indenfor akut geriatri og farmakologi
Følgende model har vi tidligere vist i bloggen om geriatrisk akutmedicin. Den er essentiel når det kommer til frailty- og den ældre i akutmodtagelsen, så hvis du missede den dér, så får du den hér en gang til:
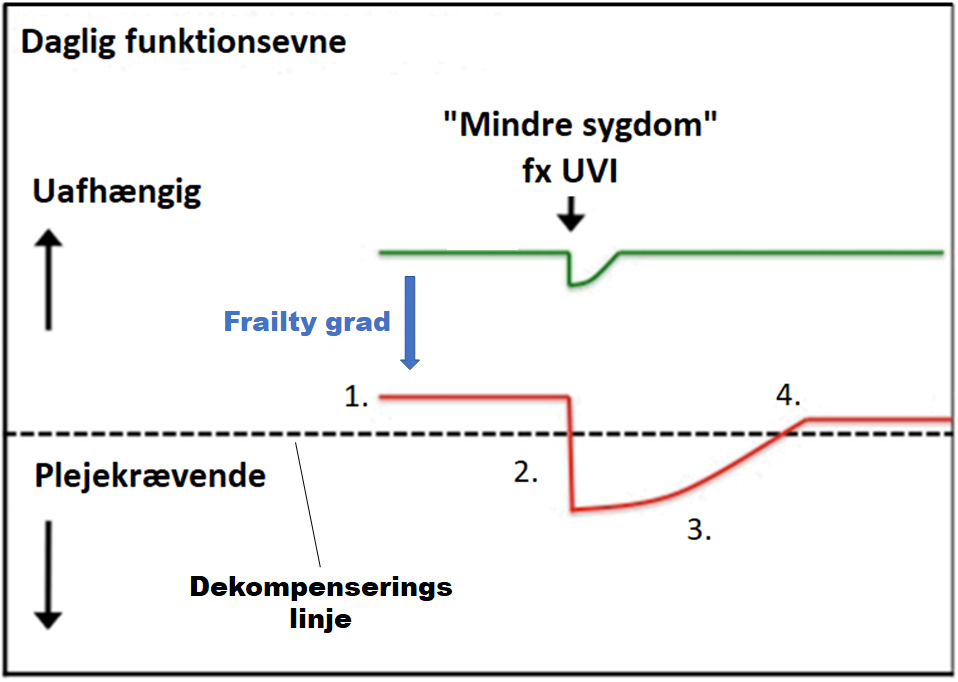
Forklaring: Grøn linje: ung patient, rød linje: ældre patient med tiltagende frailty (blå pil)
Frailty er løst defineret som biologisk høj alder med akkumulering af både kropslige problemer, og sygdomme, der resulterer i mindre modstandsdygtighed (se Clegg 2013: frailty in the elderly patient). Bemærk,at den ældre patient
Geriatrisk dekompensering er den tilstand, hvor ressourcer < stressorer, og patienten ikke længere kan føre et selvstændigt liv. På akutmodtagelsen præsenterer disse patienter med et geriatrisk dekompenseringssyndrom (delir, fald, non-specific complaints, causa socialis / uholdbar hjemmesituation, “svageste organ” syndromet), – se herunder
Anvendelse: Overstående graf illustrer, at ved en mindre stressor (fx UVI), vil en ung patient kun have minimalt fald i funktionsniveau, imens samme stressor hos en frail patient (1) vil give et betydelig større funktionsniveau fald (2) og ofte sende dem under linjen for dekompensering, hvorfor de præsenterer på din akutmodtagelse med dekompenseringssyndrom med eller uden tydelige tegn til underliggende årsag (ofte multicausal årsag – patienten vil ofte have kunnet delvist kompensere med den nye stressor: hvis de falder, har de måske undgået at gå ud af sengen, derfor nu rhabdomyolyse, sarkopeni og faldet med evt subduralt hæmatom. De har ikke spist og drukket fordi de ikke har kunnet komme ud af sengen. Alene disse delvise kompenseringsmekanismer giver AKI, som forværres af polyfarmaci. Således en ond cirkel og en meget syg patient, der “bare” præsenterer med fald).
Behandles patienten korrekt, vil de kunne komme sig, men dette tager længere tid end ved den unge (3), og de vil ikke altid komme tilbage til base-line (4)
Bemærk desuden, at “frailty” ikke er eneste årsag til permanent nedsat funktionsniveau, og i min erfaring gælder mange af de samme principper i overstående graf om oligofrene patienter (der også kan reagerer stærkt på relativt små ændringer og “dekompensere” med affekt eller adfærdsændring, eller evt anfald med til tider atypisk epileptisk udseende)
Bemærk desuden, at ved mange ældre med kroniske sygodmme, er det “svageste organ” der påvirkes først: har de lungesygdom tager de måske ikke deres medicin, eller de har ikke så stor reserve, når de stresses, og kan præsentere med KOL i ex eller dekompensering (selvom den udløsende stressor ofte misses, hvis man ikke kigger dybere). Et andet typisk eksempel, er “post-stroke recrudesence” (“uroplexi”), hvor patienten med tidligere stroke får symptom-recidiv i forbindelse med infektion.
Billedkilde: modifikation af billede fra Clegg 2013: Frailty in elderly patients

Når en tidligere velfungerende ældre præsenterer med et geriatrisk syndrom (særligt delir og/eller fald og/eller uholdbar hjemmesituation), må man betragte det som toppen af isbjerget og dykke ned (enten under indlæggelse, på akutmodtagelsen eller via egen læge opfølgning) i underliggende reversible årsager (en huskeregel er DIMES: Drugs, infections, metabolic and electrolytes, envoirenmental changes, Structural)
D: drugs og drug-withdrawal – se detaljer i denne blog. Se seponeringslisten for forslag til seponering af “high risk, low benefit” drugs (fx benzodiazepin, prostata-medicin). Nogle drugs er “high risk, high benefit” (fx blodfortyndende og opioider), og kan være de eneste patienten skal have tilbage på sin liste
For detaljer, se Clegg 2013: frailty in the elderly; Nickels og Conroy: Geriatric emergency medicine, bloggen EM3 om frailty eller emCases Ep 34
Vi har i et tidligere indlæg gennemgået vigtigheden af polyfarmaci hos den dekompenserede ældre patient – har man ikke læst dette blogindlæg, rådes at kigge på det først: Den ældre patient på akutmodtagelsen del 1
Er du stadig ikke overbevist om hvorfor geriatrisk akutmedicin, herunder polyfarmaci er vigtigt, så tjek denne prisbelønnede kortfilm ud, som fint illustrerer det vi alle ved (Mrs Andrews Story – what went wrong):
Polyfarmaci defineres som regel ved >5-10 præparater. Polyfarmaci udgør ca. 30% af årsagerne til besøg på akutmodtagelser fra ældre >65 år. Præsenterer en ældre patient med delir, fald, synkope, svimmelhed, dehydrering, AKI, non-specific complaints eller nedsat funktion i hjemmet, er gennemgang af medicinliste og pausering/seponering en af hjørnestenene af håndteringen. Det er derfor af stor vigtighed, at man som behandlende læge gennemgår patientens medicinliste og forholder sig til den, under patientens kontakt til akutmodtagelsen.
Et dusin tommelfingerregler for medicinhåndtering hos den ældre
Caring for the aged demands a readiness to imagine and a willingness to invent. Above all, it requires less reliance on drugs and more of a focus on rearranging the furniture of life
Bernard Lown, The Lost Art Of Healing, s. 230
For en kvik opfrisker om baggrunden for rådene herunder, kan man gratis registrere sig på Geri-EM, og anvende deres undervisningsmodul om medicinering. DSAM har ligeledes på deres ældre-modul et videomodul.
Her følger vores 12 råd til håndtering af medicinlisten hos den ældre patient. Du har sikkert hørt flere af understående vel-validerede råd før. Men udfører du dem? Tænk på dem næste gang du sidder med din patient
- Medicingennemgang behøver ikke være kompliceret: I den akutte situation (særligt ved AKI (Acute Kidney Injury), faldepisoder og delir), skal der som tommelfingerregel overvejes pausering / seponering / udtrapning af al medicin, som ikke er livsnødvendig (se fx seponeringslisten på sundhedsstyrelsens hjemmeside). Balancen for benefit Vs risiko er blevet forskubbet, når en ældre pludselig præsenterer med en akut problemstilling. Få mediciner kan gøre større skade end gavn, hvis de seponeres akut (fx benzodiazepiner, morfin, SSRI, prednisolon etc), og bør kun med forsigtighed pauseres.
- Start low, go slow: For at reducere risikoen for bivirkninger, når vi ordinerer ny medicin til den ældre over 65 år, gælder “start low, go slow”-princippet. Det vil sige, at man måske kun giver 50% eller måske endda kun 25% af den normale startdosis til den ældre patient – drejer det sig om akut symptomlindrende medicin som morfin eller haloperidol, kan man starte lavt, med refrakte doser
- Undgå antikolinerg load: Mange mediciner vi udskriver til ældre, har en antikolinerg effekt, som opdeles i grad 1-3. Man kan hurtigt få et overblik af patientens såkaldte “Antikolinerge load”, ud fra både IRF’s oversigtsartikel på emnet (antikolinerge lægemidler og antikolinerg load – en praktisk tilgang, 2017) eller SST/IRFs oversigt eller på seponeringslisten markeret med “AC” (anticolinergic). Du vil formentlig blive overrasket over hvor mange mediciner, der har denne effekt. Som tommelfingerregel skal disse mediciner undgås eller reduceres (særligt grad 3’erne som antihistaminer), og særligt i patienter med fald, svimmelhed og delir-tendens / demens, hvor den antikolinerge load forværrer- eller øger risikoen for alle disse tilstande.
- Risk / Benefit: Jeg ser ofte folk bange for at ordinere morfin til den ældre patient (delir pga smerter Vs delir pga morfin-problemet). Det kan hér være rart at tænke probabilistisk på det, og opdele medicin i
- High risk – low benefit (den medicin du finder på seponeringslisten): Dette er medicin, du aldrig / kun under helt særlige omstændigheder skal udskrive til den ældre. Dette omfatter fx benzodiazepiner, kodein, tramadol, NSAID, antikolinerg medicin grad 2-3
- High risk – high benefit: Dette er medicin som ofte kan ordineres under særlig instruktion for patienten og de, der skal tage hånd om dem. Man skal ofte hér tage højde for de potentielle komplikatioenr der kan forekomme, og forebygge dem (fx give anti-obstipantia ved morfin). Denne liste omfatter bl.a morfika og anti-koagulantia for at reducere risiko
- Dato på al ordineret medicin: Når du udskriver medicin til patienten som ikke skal gives livslangt, uanset hvor i systemet du er, bør der sættes en dato på (i stedet for en “til videre” ordination). På den måde sættes en “timer” på patienten, og en automatisk revurdering kan ske når medicinen løber ud. Således forebygges polyfarmaci
- Seponeringslisten 2020 og hurtig Vs langsom udtrapning: både når man ordinerer og udtrapper medicin for at undgå bivirkninger / seponeringssyndromer / abstinens. Visse mediciner kan udtrappes direkte, og for overblik, kan med fordel kigge på SST / IRF’s seponeringsliste 2020
- Fortsæt ikke automatisk patientens FMK medicin: FMK-listen skal altid opdateres – jeg ved det er en gammel traver, men det er særligt vigtigt hos de ældre. Jo mere medicin du har på listen, des større risiko for stor diskrepans imellem hvad patienten faktisk tager, og hvad FMK-listen siger. Selv mindre dosisændringer kan have konsekvenser. Overføres listen blindt, og patienten ikke tager medicinen længere (jf start low, go slow), vil de hurtigt kunne få delir. Omvendt, hvis benzodiazepinordinationen halveres brat, vil delir ligeledes risikeres. Ofte står vi i akutmodtagelsen med en patient, der ikke kender sin medicin (se punkt 10), og i de tilfælde, kan man kigge på nyligt udskrevne recepter i FMK eller alternativt blot ligge det ind, som er essentielt, og med lav sandsynlighed dræber patienten (lig fx ikke blindt 200 mg morfinækvivalenter ind uden at være sikker på, det er det, de får).
- Medicin der ikke dagligt ordineres: Medicin der ikke dagligt ordineres er en anden særlig problemstilling. Waran er hyppigt et problem, da patienten sjældent husker deres ugeskema. Må man starte fra ny kan SST/IRF’s “start af warfarin behandling”-folder, hjælpe. Andre hyppige problemer, er ved morfinplastre (hvornår fik de påsat det senest?). Vær omhyggelig med at finde ud af dette, så patienten ikke underdoseres.
- Nogle mediciner er høj-risiko ved ordination: Promedicin har længe forsøgt at gøre opmærksom på, at ved udskrivning af særlige lægemidler, er der en øget risiko for forekomst af UTH’er. Den aktuelle liste kan findes hér (promedicin -> risikosituationslægemidler)
- Lad de pårørende i ventetiden finde medicinlisten: På akutmodtagelserne er der altid nogle timers ventetid. Bed patienten / pårørende i ventetiden udfylde et skema om hvilken medicin de tager. Et gyldent princip i akutmedicin er, at hvis patientens ventetid kan udfyldes med opgaver, så går forløbet hurtigere, og de føler sig involveret. Har man særligt friske patienter, kan man gå skridtet videre, og lade dem udfylde sin tidligere sygdomshistorie også: SIDM (society to improve diagnosis in medicine), har lavet et “patient toolkit“, som man kan lave om til sin afdelings præferencer
- Compliance og pillemåltider: Hvis du nogensinde har været FADL-vagt eller bare forsøgt at gå i en sygeplejerskes eller plejehjems-personales sko, vil du vide, at ældre ikke er lette at få medicin i de ældre. Resultatet bliver ofte, at de “mindste piller” er dem der lettest sluges (uanset effekten). For den ældre ser de jo alle ens ud, og når man står overfor en uoverkommelig opgave, må man gøre det man kan. Det er altså logiskt, at den ældre patient med polyfarmaci ikke tager al sin medicin. Vælg derfor, hvis muligt hellere én gangs doseringer, end flergangsdoseringer.
- Medicinen er ikke skabt til din patient – NNT er overvurderet og NNH er undervurderet: Medicinindustrien har sjældent lavet studierne om den medicin du ordinerer baseret på den ældre patient med polyfarmaci (snarere yngre friske uden medicin overhovedet). Så den fine NNT (number needed to treat for benefit) på 60 eller 100 eller over det, som står på fx statiner, ASA og andre mediciner, gælder altså ikke sjældent / aldrig for din patient. Risk-benefit er derfor betydeligt forskubbet, og særligt når livets fase og målet med medicinsk behandling tipper fra “overlevelse og kur” til “øget livskvalitet” (dette er sjovt nok, oftest når patienten begynder at komme ind med multiple fald, delir eller svimmelhed), må vi virkelig være kritiske over al profylaktisk og “kurativ” medicin vi ordinerer, og nærmere tænke på NNH (number needed to harm for benefit), som nok er en del højere ved din patient. NNT/NNH overblik kan fås her: TheNNT.com
Clinicians more often underestimated rather than overestimated harms and overestimated rather than underestimated benefits. Inaccurate perceptions about the benefits and harms of interventions are likely to result in suboptimal clinical management choices.
Hoffman et al, 2017: Clinicians’ Expectations of the Benefits and Harms of Treatments, Screening, and Tests: A Systematic Review
Medicingennemgangen på akutmodtagelsen
Generelt bør man overveje følgende punkter i sin klinisk farmakologiske tilgang til patienten i akutmodtagelsen:
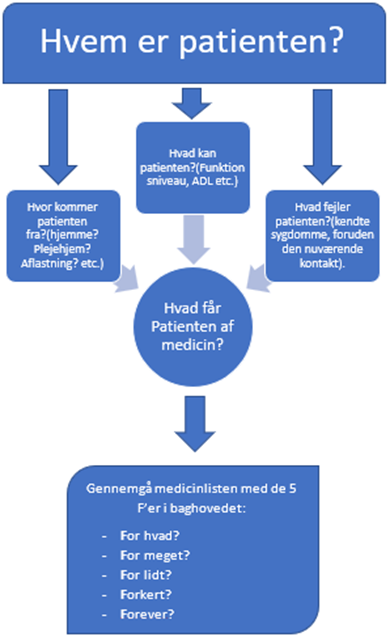
Forslag til konkrete værktøjer der kan bruges i klinikken omhandler følgende:
- Overvej altid indikationen for lægemidlet – er indikationen fortsat tilstede? Hvis ikke: Hvordan håndteres seponeringen bedst?
- Hvilke lægemidler skal jeg overveje at pausere / seponere? – Anvend IRF / SST’s seponeringsliste. IRF og DSAM har udmærkede guides til medicingennemgang. Andre hyppigt anvendte værktøjer til medicingennemgang findes hos geriaterne og omhandler: START STOPP listen fra DSG og Beers criteria 2019.
Hos særligt den geriatriske patientgruppe bør følgende altid overvejes:
- Lægemidler / lægemiddel kombinationer, der øger risikoen for fald:
- CNS sløvende lægemidler: fx benzodiazepiner, antihistaminer, antikolinergika, antipsykotika, antidepressiva og visse smertestillende (særligt tramadol, men muligvis også andre syntetiske morfika)
- Ortostatisme inducerende lægemidler: NO-donorer, antihypertensiva, antikolinergika, 5 alfa-reductase hæmmere (fx finasterid)
- Polyfarmaci øger i sig selv risikoen for fald!
- Lægemidler, der øger risikoen for delir
- HypoNatriæmi inducerende lægemidler (fx SSRI, thiazider, TCA)
- Antikolinerg load: se antikolinerg load listen via SST (eksempler: antihistamin, midler imod overaktiv blære, antiparkinson midler, clemastin, anti-demens medicin)
- Ubehandlede / dårligt sanerede smerter
- Smertestillende der kan sløre CNS
Ved fortsat indikation for lægemidlet, men uhensigtsmæssige bivirkninger fx i form af sløvhed, delir, ortostatisme mm., kan man i første omgang forsøge at nedtrappe dosis og se an på om bivirkningerne remitterer, inden man evt. langsomt udtrapper lægemidlet fuldstændigt.
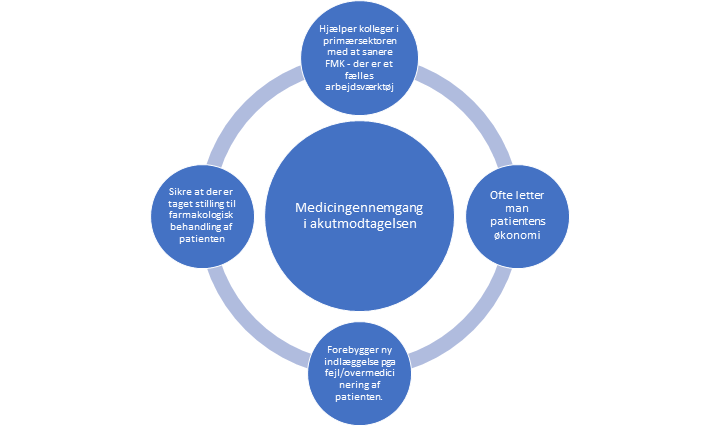
Virkeligheden er ofte den, at primærsektoren er presset af stadigt flere patienter til færre almene medicinere. Derfor kan man som behandlende læge i akutmodtagelsen hjælpe egen læge på vej, ved at lave en medicingennemgang og notere ændringer i epikrisen i punktform, så egen læge kan orientere sig. Dette skal ikke gøres ved alle patienter, men skal ALTID gøres ved patienten med AKI (akut kidney injury), og bør overvejes ved patienter med “geriatrisk dekompenserings syndrom” (fald, delir m.m), som tyder på frailty.
Medicingennemgangen løser flere problemer:
Kilder
- Therapeutics Initiative – Reducing polypharmacy: A logical approach
- DSAM – den ældre patient
- Beers criteria 2019
- START STOPP list
- Seponeringslisten 2020
- UpToDate
- SST
- IRF: https://www.sst.dk/da/viden/laegemidler/medicingennemgang/antikolinerge-laegemidler
- DSG
Administrationsmetoder:
Patienten der ikke kan tage p.o. og aspirationsrisiko
Må pillen knuses? af den ene eller anden grund, kan patienten til tider ikke få sin medicin p.o, men må nøjes med IV. Bemærk, at der i de seneste år er kommet væsentlig evidens der tyder på, at IV IKKE er bedre end p.o ved gennemsnitlige infektioner (jf fx First10EM: magical thinking in medicine). Indikationerne er i stedet ofte patienten ikke kan / må sluge pga aspirationsrisiko eller faste.
Her må man ofte prioritere risk:benefit for patienten, og udvælge den medicin, som patienten ikke kan undvære. Eksempler på hyppig anvendt potentiel vigtig medicin, der ikke kan gives IV er
- Antihypertensiva (med undtagelser af stoffer, der sænker blodtrykket hurtigt som fx labetelol, nitroglycerin-præparater og hurtigtvirkende betablokkere)
- Blodfortyndende behandling (waran, DOAC / NOAK etc) – et alternativ kan ofte være fragmin IM
En liste over p.o -> IV kan findes hér (Region Midtjyllands “må tabletten knuses”-serien som årligt opdateres, senest 2018). Promedicin har lavet en film om emnet fra 2016:
Har patienten aspirationsrisiko? Det er vigtigt at have lidt realisme hér. Som næsten alt andet, så er aspirationsrisiko ikke en dikotomi (enten / eller), men et spektrum.
Den akutte forbigående aspirationsrisiko: En bevidsthedssænkt patient vil altid have nogen grad af aspirationsrisiko – særligt hvis seneste måltid var <6 timer siden, eller de har andre årsager til at aspirere (maskeventilation med luftblæsning til ventriklen, kramper, øget intrakranielt tryk, intoksikation etc). En dybere gennemgang af dette bliver en anden gang. I stedet vil vi fokusere på de farmakologiske aspekter af dysfagi hos patienter der i længere tid (dage til år) ikke vil kunne indtage p.o.
Akut længerevarende- eller permanent aspirationsrisiko: Dette er fx når vi får patienter ind på akutmodtagelsen med stroke. Dysfagi forekommer hos 37-78 % i den akutte fase. Patienten med stroke og dysfagi vil uanset hvor meget man forsøger at forhindre det, fortsat have mikroaspirationer, og derfor skal der altid ved disse patienter overvejes administrationsmetode for medicin. En hurtig screeningstest for patientens synkefunktion er at give dem et glas med lidt vand – hoster de eller desaturerer de i forbindelse med forsøg på at synke, skal de gennemgå en formel synke-undersøgelse og 0-per-os ordineres.
Patienten med kroniske synkeproblemer og PEG (Perkutan endoskopisk gastrostomi): Har patienten en PEG, behøver medicinen ikke gives IV, men kan (oftest) i stedet gives direkte i PEG’en. PEGen er dog ingen mirakelløsning ift aspirationsrisiko, og den har ikke bevist at være bedre for patientens risiko for aspiration- og pneumoni, hvis de er sengeliggende
Reduction in the chance of pneumonia has been suggested for non-bed-ridden post-stroke patients in one prospective, non-randomized study. For bedridden post-stroke patients, no reduction was observed
Fast Facts, Tube Feed or Not Tube Feed? – palliative care network of wisconsin
Der findes særlige “aspirationsreducerende” PEG sonder, men selv med disse, vil regurgitation stadig forekomme og mikroaspirationer er uundgåelige. Det er derfor vigtigt at patienten sidder op, når de skal have medicin og mad i PEG’en og at sedering reduceres til et minimum.
Det er ikke sjældent PEG patienten er i delir eller sederede, og man på akutmodtagelsen er nødt til at træffe et valg om at anvende PEG’en eller give IV. Generelt kan sådanne beslutninger ofte vente til afdelingen, og man kan købe sig tid ved at give den essentielle medicin IV, og behøver patienten ernæring, kan man til nød opstarte glukose-drop indtil en ernæringsplan kan oprettes.
Eksempler på hyppige årsager til dysfagi er
- Stroke (hyppigst – ofte delvist reversibel)
- Neuromuskulær sygdom (fx huntingtons chorea)
- Sedering
- Mekanisk påvirkning af oesophagus
Hvilke administrationsmetoder skal vi være forsigtige med?
Nogle formuleringer kan være fristende at give på de ene eller anden måde, men bør foretrækkes i en særlig formulering
Da jeg (Peter) arbejdede i psykiatrien, havde vi nogle formuleringer og kombinationer vi ikke ville give. Evidensen for dette er svag, og jeg ved, at hvor jeg praktiserer nu, har man ikke disse restriktioner. Endnu engang vil jeg slå et slag for, at vi – når vi sætter restriktioner – forsøger at nævne den relative risiko, NNH eller lignende, så man kan se dimensionerne i hvad vi laver. ALT VI LAVER er risikofyldt – det er bare et spørgsmål om, hvad der er mere end andet:
Haloperidol: Pga øget risiko for QTc forlængelse frarådes det oftest i Danmark at give haloperidol (serenase) IV. Til trods for dette, anvendes det i udlandet, men ofte under nærmere monitorering (telemetri, EKG og QTc aflæsning). Sammenlagt er risikoen for QTc forlængelse og den frygtede TdP i litteraturen sparsomt beskrevet. Bedste evidens jeg har kunnet finde var dette studie , selvom det dog indirekte er velbeskrevet i større studier (2/196 ITA patienter med delir fik TdP, dog usikkert om kausalitet). Dog er det uklart, hvor meget større risiko der ligger ved IV Vs IM administrering. Som udgangspunkt må man give IM, og altid vurdere patientens andre risikofaktorer (som hjertesygdom eller polyfarmaci med QTc forlængende medicin, QTc før administration >450-550 ms etc). Overodnet er mindre doser af IV haloperidol hos lav-risiko patienter (fx ifb kvalme / opkastning) formentlig lav-risiko. Men måske vi skal gå en anden vej? – PulmCrit foreslår, at vi måske skulle begynde at gå over til IV olanzapin?
Olanzapin og benzodiazepiner: Kombinationen af benzodiazepiner og olanzapin i alt andet end p.o, skal foregå med >2-4 timers mellemrum – i særdeleshed IM olanzapin + p.o benzodiazepin (i Sverige er denne kombination “husets vin” i psykiatrien vi samarbejder med, men jeg er stødt på forbud imod det i Danmark). Kilden til denne anbefaling er fra producenten af olanzapin, og der kan læses mere herom fra denne kilde
IV naloxone Vs IM naloxone (obs følgende er kontroversielt, og indgår endnu ikke i danske guidelines): Man skal altid være forsigtig med IV naloxone – ikke fordi det er så farligt i sig selv. Men den klassiske problemstilling med at give høj dosis til patienter med et opioidtoxidrom er problematisk , fordi patienten vågner brat, får abstinens og løber ud (og det gør de!), med det resultat af
- En del af akutmodtagelsen ofte ødelægges på vejen ud
- Patienten er en fare for personalet i denne tid
- T½ af naloxone er kort nok til ikke at virke hele brænderten ud. I bedste fald kommer patienten derfor ind igen når de kollapser igen, og i værste fald findes de ikke, der hvor de kollapser, og kan dø af deres intoxication
- Abstinens: Til tider vil de i perioden, hvor naloxon virker, tage en ny dosis opioid for at forhindre de ubehagelige abstinenser. Dette gør situationen endnu værre end da de kom ind, når naloxon-perioden forsvinder.
Mit personlige råd er derfor (og sådan, vi praktiserer, der hvor jeg arbejder): kan de holde luftveje, saturation >90-92%% og en respirationsfrekvens (RF) >6-8 (obs: dette er ikke guideline baseret, men pragmatisk ud fra erfaring) er det oftest bedst bare at lade dem sove ud under observation af klinisk tilstand, saturation og RF.
Er man nødt til at give naloxone (fx ved overskridning af overstående, hurtig progression i tilstand, kendskab og stor overdoseringsbolus med fentanyl eller heroin m.m), gives de i små refrakte doser (evt I.M, så patienten har et depot, hvis de vågner), indtil overstående er opnået
Standard startdosen er mange steder 0,4 mg. Medforfattere til kapitlet om opioid-toxidrom behandling, i den toxicologiske bibel (Goldfranks) beskriver i en AliEM blogpost dog, at startdosis kan være mindre – faktisk 1/10 fortynding! (dvs 0,04 mg – kan gentages hvert 1-5 min alt efter effekt)
“this dose [0.4 mg] in an opioid-dependent patient usually produces withdrawal, which should be avoided if possible. The goal is to produce a spontaneously and adequately ventilating patient without precipitating significant or abrupt opioid withdrawal. Therefore, 0.04 mg is a practical starting dose in most patients, increasing to 0.4 mg, 2 mg, and finally 10 mg.”
En mindre caseserie på 15 patienter af samme forfatter, hvor man gav refrakte doser med 2-3 min mellemrum, og fordoblede dosen mellem hver gang: 0,04 mg -> 0,08 mg -> 0,12 mg, viste ligeledes fremragende resultater:
“The median total naloxone dose required for clinical reversal of acute opioid-induced ventilatory depression was 0.08 mg (range, 0.04 to 0.12). Forty percent of cases (n=6) required single dose of 0.04 mg; six cases required total naloxone dose of 0.08 mg, and threecases required 0.12 mg. The median RR after naloxone ad-ministration was 13 breaths/min, with corresponding normal-ization in pulse ox and ET-CO2 ” (Kim et al, 2015)
Der findes dog tidspunkter, hvor store doser naloxone er nødvendige
- Peri-arrest: er patienten RF 2-4 , SAT <90% og/eller kan ikke holde luftveje trods basale luftvejsmanøvre
- Hjertestop: start fx med 2 mg (se EmCases Ep 116)
- Særlige intoxicationer skal man være forsigtige med (fx fentanyl – kan behøve store doser): En metode foreslået af EmCases er, at starte med 0,4 mg, og hvis ingen effekt efter 3 minutter da gives 1 mg og siden fordobling af dosen hver 3. min (dvs. 2 mg, 4 mg, 6 mg. Når man >12 mg naloxone, som kan ske ved fentanyl, må man overveje intubation)
Vil du vide mere om denne hyppige patientgruppe i akutmodtagelsen, anbefales Emcases Ep 116
Bottom line: Ved mistanke om opioidintoxication, er det sensibelt at observere patienten på RF, SAT og A-problem. Går patienten den forkerte vej (ihht jeres lokale guidelinebeskrivelse), gives naloxone. Der foreligger efterhånden mere og mere evidens for sikkerheden ved at give refrakte lav-dosis naloxone startende fra 0,04 mg og optitrering hvert 3. min indtil effekt på RF, SAT og A-problemet. Denne mere forsigtige teknik for at reducere risikoen for abstinens, og at patienten forlader akutmodtagelsen uden observation er mulig når Naloxone går ud af kroppen. Særlige tilfælde kræver højere dosis nalxone (se herover)
Kilder
- Region M: Må tabletten knuses 2018
- Promedicin: må tabletten knuses (youtube, 2016)
- MyPcNow.com = palliative care network of wisconsin og deres fantastiske “Fast Facts and Concepts”, side
- EmCases Ep 116 Emergency Management of Opioid Misuse, Overdose and Withdrawal
- ALIEM: Trick of the Trade: Naloxone Dilution for Opioid Overdose
- Kim et al, 2015: Reversal of Opioid-Induced Ventilatory Depression Using Low-Dose Naloxone (0.04 mg): a Case Series
Nutrition som medicin
Dette er et område, vi med rimelighed ikke behøver kende meget til på akutmodtagelsen. Dog er vi starten af patientens forløb, og jo bedre start patienten får, des bedre downstream-behandling på afdelingen.
SST har lavet guidelines for nutrition, men min erfaring er, at der er meget lidt fokus på emner som ernæring og sarkopeni på et akutsygehus – særligt på akutmodtagelsen.
Jeg tror derfor ikke kun det er viden vi behøver på dette område – det er inspiration
Her er to af de mest interessante lekturer jeg nogensinde har hørt om nutrition – Kan vi afhjælpe, at selv unge patienter 6 måneder efter ITA-indlæggelse stadig har lav livskvalitet, og besvær med mobilisering? Giver det mening at indlægge ældre sarkopene patienter på ITA? Hvordan vendes sygdomsinduceret katabolisme? Og er det kontraproduktivt at give ernæring i nogle tilfælde?
Lidt mere spændende spørgsmål end kalorie-regning og SST’s guideline i ernæring. For inspiration og forsøg på svarene på overstående spørgsmål dette lektur af internationalt anerkendte anæstesiolog og patient Poul Wishmeyer (youtube: Surviving the ICU – the patient experience, eller mastering intensive care: https://masteringintensivecare.libsyn.com/episode-35-paul-wischmeyer-never-underestimate-the-simple-things-we-do-to-our-patients )
Og dette lektur fra SMACC 2019
Bottom line: It’s complicated…Katabolismen som induceres ved svær sygdom er svær at revertere – selvom man giver kalorier nok. Måske vil et øget kalorieindtag endda skade patienten. Dette er et spændende område, som vi desværre ikke ved så meget om endnu.
Allergi, CAVE og nocebo-effekt

Forskellen på allergi, intolerans, virkning af medicin og bivirkning kan være forvirrende for både læger og patienter. Det er dog vigtigt, at det registreres rigtigt, da en forkert registrering kan eksistere som et “journal-spøgelse” der copy-pastes i al evighed indtil den dag, hvor de faktisk behøver medicinen.
At the top of each letter was a list of medical problems. The most recent one read: migraine, arthritis, angina, IBS, possible hypertension, abnormal liver function tests […]. I recognized the list, I hade seen many like it before. It was the list that one junior doctor copies from the most recent letter in the notes into the letter they are currently writing. Lack of experience sees them underestimate the necessity of checking every fact. In that way a medical history can take the form of Chinese Whispers. “Chest pain under investigation” is slowly transformed into “angina” […]. A readthrough of her notes told me it had been ruled out, even though the diagnosis lived on in the legend of her letter.
Suzanne O’Sullivan: It’s All In Your Head, 2016 – s 68
Et særligt stort problem er “overregistreringen” og “fejlregistrering” af penicillin allergi, hvilket effektivt gør, at folk ikke er i stand til at få penicillin. Konceptet nævnes bl.a. i denne podcasts fra EmCases, og en en nyligt publiceret statusartikel i ugeskriftet sætter også fokus på dette problem: Tannert et al 2020 i ugeskriftet , og dette er anbefalet supplerende læsning til dette afsnit

Som udgangspunkt må man ved CAVE forsøge at registrere
- Er der tale om Allergi eller intolerans, eller ved man ikke?: Det hele er selvfølgelig noget patienten føler “de ikke kan tåle” – men for os klinikere er distinktiveringen meget vigtig.
En allergisk reaktion er en immunologisk lokal eller systemisk reaktion. Den værste reaktion vil være anafylaksi og/eller svært angioødem (patienten ved som regel om de har fået adrenalin / epipen for deres reaktion?). Patienten vil ofte have haft lignende reaktioner før, og der vil ofte være en klar exponering->reaktion ved de alvorligere tilfælde. Har patienten astma / atopi sygdomme i familien?
Ved intolerans vil man ofte forstå, at kroppen over-exponeres ift dens ressourcer til at processere en særlig ting (fx gluten, laktose eller lignende). Intolerans er altså lidt en “misnomer”, da der sjældent er tale om total “intolerans”. Det er i stedet et spektrum gående fra, at patienten er total intolerant til mindre grad intolerans. Nogle tilstande findes både i allergi-form og intolerans-form (fx gluten allergi og gluten intolerans).
Mange patienter har svært at skelne intolerans fra “bivirkninger” (fx ved morfin) – ofte fordi de ikke har fået ordentlig information inden de fik medicinen. Bemærk også nocebo-effekten (se herunder), hvis patienten har symptomer, der opstår hurtigt efter indtag, og ikke har objektive fund, eller er atypiske ift hvad du vil forvente ved intolerans eller allergi. - Exponering, tid til symptomer og symptombeskrivelse: Optimalt beskrives, hvor lang tid der gik imellem exponering og reaktion, hvor stor exponeringen var, og hvike symptomer der udvikledes og hvornår.
- Hvilken medicintype/exponering, dosis og præparatnavn, samt dato og hyppighed af anfald
- Typen og alvorlighed af anfald; situation (var patienten indlagt eller hjemme – var der sygdom samtidig med behandlingen)
- Udredning for allergi (er den bekræftet ved provokationstest eller er allergien fundet for farlig/åbenlys til provokation)
Uklarhed kan føre til, at patienter får suboptimal behandling næste gang.
Behøver du i den forbindelse et brush-up på den store allergiske reaktion (udover TEN /SJS) vi alle er bange for, findes her en udmærket podcast om det – Anafylaksi: https://emergencymedicinecases.com/anaphylaxis-anaphylactic-shock/
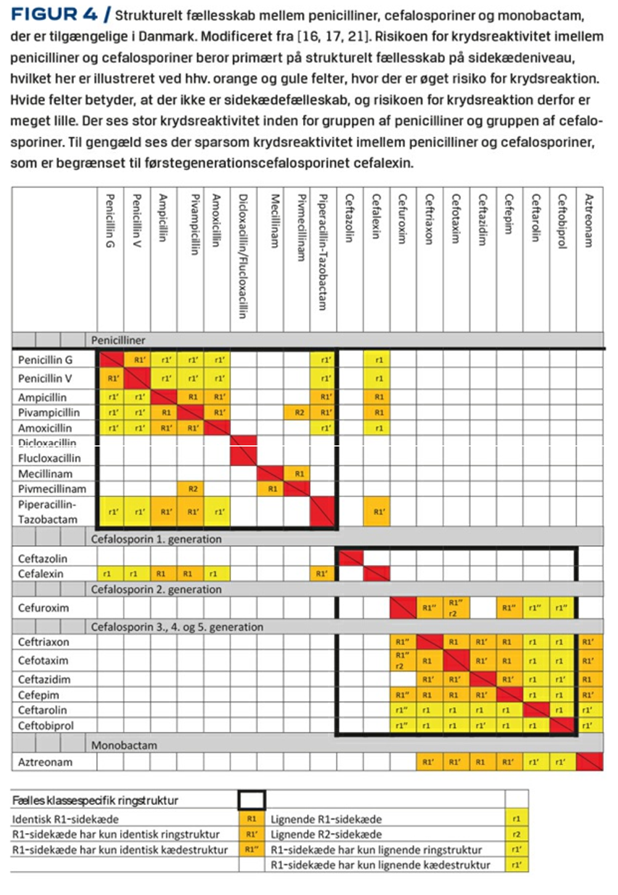
Medicinering på trods af CAVE: Man må ikke se CAVE-medicin som at patienten aldrig får lov at få medicinen igen. Der findes selvfølgelig undtagelser , hvor risikoen er enorm fx ved nylig tydelig verificeret anafylaksi eller TEN/SJS. De få patienter, der har ægte allergi med udvikling af fx tryptase-positive alvorlige anafylaksi- eller angioødem symptomer, skal respekteres i ordinationsbeslutningen. Penicilliner kan ofte erstattes med cephalosporiner (lav kryds-allergi) eller makrolider.
Ofte er sandsynligheden for alvorlig skade dog meget lav og en risk-benefit bedømning er mere passende ift risikoen ved at undlade (det er jo også en risiko for patienten, der IKKE kan få penicillin). Har patienten fx CAVE for penicillin, fordi hun har haft lidt urticaria som barn ifb penicillin, og ingen atopi i familien, kan man nu i middelalderen nok give dem en dose penicillin under observation ved indlæggelsen. Foreligger usikkerhed, og er medicinen vigtig (Fx penicillin), må man på det kraftigste opfordre patienten at blive udredt / provokationstestet, for at man i fremtiden kan give medicin, hvis det behøves.
Sensibilisering Vs Allergi: Nogle patienter, vil efter en allergologisk udredning til tider kalde sig “allergiske” overfor alle de stoffer de slår ud imod. Dette er forkert. Der er i stedet tale om “Sensibilisering” (patienten har haft et panel af allergi-tests udført, hvor de gav udslag for nogle slags stoffer) og “allergi” (patienten reagerer på et stof). Sensibilisering er IKKE det samme som allergi, men i bedste fald en risikomarkør for at patienten MULIGVIS kan reagere på disse stoffer. Først når patienten demonstrativt udvikler en allergisk reaktion i “virkeligheden” imod et af de midler, som de er sensibiliserede imod, vil man kalde dem allergiske (man kan for nogle stoffer, tage antistoffer i blodet, og sandsynliggøre en allergi).
Hyppige “allergi”-status på patienter, der ikke er allergi:
Man har mistanke om penicillinallergi hos omkring 10% af hospitalsindlagte patienter i Danmark, men det har vist sig, at allergi kan afkræftes hos 80-90% af dem efter relevant vurdering og udredning
Udredning af penicillinallergi, Tannert et al, 2020
- Morfin: Kvalme og opkastninger er ikke en allergi – oftest en bivirkning. Skift præparat eller reducer dosis
- Penicillin allergi: Enormt få af dem, der angiver de er penicillin allergikere har ægte penicillin allergi. Har de ikke været allergologisk udredt eller provokationstestet, eller har de ikke overbevisende symptomer (fx anafylaksi eller angioødem), så er sandsynligheden for en ægte allergi lav. Ofte er der også alene tale om en enkelt episode som aldrig er blevet bekræftet, og var i barndommen.
- Lang liste af CAVE-medicin +/- psykiatri historie: Led efter en allergologisk udredning og gå efter den (vil være mærkeligt, hvis en så allergisk person aldrig har været udredt). Oftest vil der være tale om nocebo-effekter. Særligt, hvis det er midler, som man normalt ikke udvikler allergi imod.
Vigtigt om bivirkninger Vs allergi / intolerans
Modern society likes the idea that we can think ourselves better. When we are unwell, we tell ourselves that if we adopt a positive mental attitude, we will have a better chance of recovery. I am sure that is correct. But society has not fully woken up to the frequency with which people do the opposite – uncounsciously think themselves ill. But how many are aware of the frequency with which our emotions can produce serious disability where no physical disease of any sort exists to explain it?
Suzanne O’Sullivan, It’s All In Your Head, s 5
Ofte er det, som patienten beskriver som allergi / intolerans egentlig en medicinbivirkning. Og til tider er det noget helt andet:
Nocebo effekten: En enorm mængde medicin registreres som “CAVE” pga noceboeffekten. Patienten er enten ikke blevet informeret om konceptet “nocebo-effekt”, og/eller ikke informeret om normale bivirkninger til medicinen. Stemmer kronologien af udviklingen af bivirkningerne og/eller bivirkningernes karakter ikke overens med kendskabet til stofferne (jf fx promedicin), er der stor chance for at patientens “bivirkning” er en noceboeffekt (ubehag konceptet med at tage medicin / gå til læge etc). Nocebo-effekten vil desuden ofte komme til udtryk som medicinbivirkninger (eller det patienten tror er allergi eller intolerans), der ikke er typisk / beskrevet eller meget vag. Har patienten mere end 1-2 allergier / CAVE’er uden en allergologisk udredning eller anden beviselig effekt og/eller har de angst, somatiserende adfærd, funktionel sygdom eller anden tilstand der gør dem “sensitive”, er det yderst vigtigt at forklare om nocebo effekten inden opstart og inden man beslutter sig for at sætte medicinen som CAVE.
Choicebo effekten: Et nyt begreb er “choicebo” effekten. Det beskriver, at patienten der får et valg (shared decision making) i højere grad har effekt fordi de har været medvirkende i beslutningen (hvilket er logisk når man tænker over det). Det er dog særligt, når patienten er kendt med lignende symptomer (fx smerte) (for detaljer jf Emcases quick hits 11)
Non-allergiske / intolerans medicinske CAVE’er: Dette kan fx være at pt har været behandlet med cisplatin og aldrig må få aminoglykocid
Start low go slow: Mange bivirkninger opstår som følge af for hurtig opdosering. Reducer dosis og prøv igen. Virker det ikke, og er det ikke nocebo-effekten der er årsag, må man have en shared decision making samtale med patienten omkring bivirkning Vs effekt, og hvad der vejer tungest for livskvalitet

As the patient is empowered the doctors curing power is enhanced
Bernard Lown, The Lost Art of Healing