Opdateret 2/7-20
Se følgende opdaterede kilder fra juli 2020:
- The ISCHEMIA trial (Dr Mandrolas posts): https://www.medscape.com/viewarticle/921464
- Does observation for ACS make any sense (First10Em): https://first10em.com/does-observation-for-acs-makes-sense/
HEART SCOREN – pitfalls og pearls
Update 2/7-20: Video fra skaberen af HEART-scoren (Dr Barbra Backus), findes nu som en hurtig review af, hvordan man ønsker at score en patient med HEART-scoren:
De seneste år, er HEART-scoren blevet velvalideret som CDR (clinical decision rule) og hjælpemiddel til gestalt og anamnese. Som vi gennemgik i del 1, så er HEART-scoren (eller nogen anden CDR) formentligt ikke bedre end klinisk gestalt, og skal derfor ses som et supplement i tvivlstilfælde snarere end et screeningsværktøj for alle med brystsmerter
Basics om HEART-scoren er allerede blevet glimrende gennemgået af vores venner på DKakut.dk (http://dkakut.com/heart-score/ ), så inden du går videre, kig derover for gennemgang.
Vil du have lidt ekstra, så er følgende video er en quick tour om evidensen bag HEART scoren:
Er HEART-scoren god nok til danske akutmodtagelser?
Vi anvender ikke HEART-scoren alle steder i Danmark endnu, hvad jeg ved af, og HEART-scoren er ikke nævnt på cardio.dk.
Dette kan der være relevans i, eftersom de lande, hvor HEART-scoren er studeret, ikke har “lukkede” akutmodtagelser som vi ganske unikt har i Danmark – dvs kræver visitation af almen praksis læge (udover i region H, hvor 1813 har taget over, med resulterende flere patienter på akutmodtagelsen – jf danmarks statistik data herunder efter 1813s inførsel i 2013).

Bemærk: man kan altid argumentere, at 1813 finder en “untapped source”, der ikke har tilgang til sundehedssystemet, og ville dø / lide svær sygdom, havde de ikke kunnet ringe ind. Dette har jeg dog ikke kunnet finde statistik der bygger op om.
Populationen af akutmodtagelsepatienter i Danmark (og Norge) er således “sygere” (higher acuity / højere risiko for alvorlig sygdom), end dem vi fx ser i Sverige, Holland, England, USA og Canada , da deres system er designet med “åbne” akutmodtagelser. Det betyder altså, at patienten kan gå hvorhen de vil (almen praksis, akutmodtagelse eller tredje steder – som jeg vil forklare om i kommende blogs), når de bliver syge, og er derfor ofte en ufiltreret population. Resultatet er at man disse steder ser en “low acuity” population på akutmodtagelserne (“ufiltrerede almen praksis patienter” som udgør majoriteten af patienterne, blandet med den population vi ser i Danmark – således en fortynding af alvorlige tilstande).
Vi skal altså passe på, når vi applicerer studier på HEART-scoren lavet i en “raskere” population til vores danske forhold med en forholdsvist “sygere” population (flere AKS’er i vores population), da vi kan risikere at miss-raten er højere i Danmark, hvis HEART-scoren indføres. Dette gælder for alle tilstande vi ser (således skal vi generelt passe på, at applicere udenlandske studier på vores ganske unikke danske / norske høj risiko population). Man kan dog måske argumentere for, at i tilfældet med brystsmertepatienten, så kan HEART-scoren nok med rimelig anvendes, da politiken i Danmark de seneste år har været, at majoriteten af patienter der har brystsmerter skal ses på akutmodtagelsen til udredning. Særligt kan HEART-scoren nok appliceres i København, der pga telemedicinsk visitation / 1813 (uden et ondt ord om dem i øvrigt), nødvendigvis som resultat vil få lavere acuity patienter på akutmodtagelserne. Den Københavnske akutmedicinske population nærmer sig således asymptotisk udenlandske forhold.
Hvordan ser HEART-scoren så ud i disse lav-risiko populationer?
Lad os antage, at HEART-scoren kunne anvendes i Danmark. Hvordan ser den så ud?
HEART-score algoritmen fra lande, med low-acuity patienter ser således ud: Følgende algoritme er fra min arbejdsplads i Region Stockholm, Sverige:
For detaljer om den svenske akutmedicinske algoritme jf
- Ljung, 2018: EARLY DIAGNOSIS AND RISK STRATIFICATION IN PATIENTS WITH SYMPTOMS SUGGESTIVE OF ACUTE CORONARY SYNDROME
- https://vardgivarguiden.se/Behandlingsstod/vardriktlinjer/akut-hjartsjukvard/AKS/Diagnoskriterier-vid-kranskarlssjukdom/

Jeg vil fokusere på lidt kontroverser og pitfalls ved at anvende HEART-scoren ud fra min erfaring hvor jeg arbejder:
Deltatroponin: Har patienten en initial troponin <5 efter 2-3 timer (varians mellem algoritmerne), vil patienten være lav nok risiko til at sende hjem. I nogle mange tilfælde behøves dog mere end én prøve, som vi kender det fra tidligere troponin-assays – ventetiden er dog væsentligt afkortet. Tilfælde, hvor mere end én troponin skal anvendes er når:
- Patienten kommer indenfor 3 timer, og den potentielle hjerteskade ikke med stor nok sikkerhed resulterer i troponinslip.
- Den kan også anvendes, hvis patienten har en første troponin mellem 5-14 Ifølge.
Hér vil man så tage en ny troponin om enten 1, 2 eller 3 timer fra første troponin, for at sikre at en eventuel stigning (eller faldet – alt efter hvor sent patienten søger, og kurven eventuelt er på vej ned) er lille nok til at kunne tilskrives tilfældig variation.
I Sverige anvendes 1-times grænsen: er en delta troponin taget med 1 times mellemrum og den ikke stiger mere end 2 ng/L, så vil man kunne sende den patient hjem.
Der stilles dog spørgsmål ved 1-times troponinen i litteraturen. Dette illustreres i EMCases Ep 128: Low risk chest pain. Det argumenteres hér, at 1-times delta troponin er for usikkert fordi vi arbejder i nanogram: Random varians når man arbejder med ændringer på 2 nanogram/L, er i underkanten. I den Stockholmske algoritme advarer de også imod at anvende algoritmen ved smertevarighed <2 timer. En mere sikker metode er formentlig som foreslås i EmCases Ep 128, at anvende en 2-timers deltatroponin med 4 nanogram/L ændring.
Absolutte værdier Vs relative værdier: Formentlig er den absolutte ændring bedre end den relative ændring i delta-troponin. Ved mindre værdier har det mindre betydning, men har man første troponin, der er høj, skal der en tilsvarende høj stigning til for at en relativ stigning giver “rule in” (kilde: EmCases Ep 128)
HEART-scorens anvendelsesområde: Bemærk også, at du ikke blindt kan afhænge af HEART-scoren for din diagnose. Du behøver Gestalt og Anamnese mere end noget andet.
Som med alle CDRs, skal de primært anvendes ved tvivl (EmCases Episode 56 The Stiell Sessions: Clinical Decision Rules and Risk Scales): Har patienten en høj præ-test sandsynlighed, giver det ingen mening at lave HEART-scoren (fx hvis de har tydelige anamnestiske symptomer, EKG forandringer og/eller troponin slip med tydeligt tegn på OMI). På samme måde skal vi ikke anvende HEART-scoren som en screening af alle patienter, der kommer ind på akutmodtagelsen med enhver form for smerte omkring thorax/abdomen, som du gestalt-mæssigt overhoved ikke mistænker er AKS – ifølge EmCases findes studier på, at en strikt anvendelse af HEART-scoren uden gestalt, vil betyde at vi misser 4% af MACE (EmCases Ep 128)
Er HEART scoren ≤3-4 og et normalt eller uændret EKG fra tidligere og høj sensitiv troponin er normal, så vil selv en patient med høj præ-test sandsynlighed være ganske lav risiko efter denne udredning. Ifølge studierne på 0,7-1,9% MACE på 30 dage.
Er det ≤3 eller ≤4, der er lavrisiko patienter? I har måske bemærket, at jeg veksler imellem ≤3 og ≤4. De originale studier på HEART-scoren siger ≤3 for en MACE på 0,7-1,9%. Men som beskrevet herunder, så indeholder MACE elementet “revaskularisering”, som er et tvivlsomt outcome. Derfor har man kørt tallene i studierne igen uden revaskularisering, således at det kun er mortalitet og morbiditet, som hard outcomes. Resultatet blev at patienter med heart score ≤4 nu var lav-risikogruppen.
MACE (major adverse cardiac events) Vs POEM (patient oriented outcome that matters)
Hvad er MACE? Lad mig illustrere dette med et kontraspørgsmål: Hvad er det vi forsøger at finde på akutmodtagelsen? Vi forsøger at finde OMI.
HEART pathwayen giver os dog ikke risikoen for OMI, men risikoen for MACE indenfor de næste 30 dage.
MACE (major adverse cardiac events) indenfor 30 dage består i studier oftest af flere ting:
- Mortalitet og morbiditet fra hjerteårsaget event
- Revaskulariserings procedure udført
Mortalitet og morbiditet er POEM (patient orientet outcome that matters). Men ”Revaskularisering” derimod er kontroversielt (jf diskussionerne om NSTEMI og OMI i del 2 og CAD herunder). Revaskularisering af anatomiske læsioner har ikke vist nogen sikker fordel for patienter. Justin Morgenstern skriver i sin analyse af litteraturen på området:
“Outside of STEMI (or more correctly, acute occlusal MI, because not every acute coronary occlusion has ST elevation) there does not seem to be any significant benefit to invasive interventions. In NSTEMI patients, there may be a small benefit in subjective outcomes, but it is closely balanced by harms. In the low risk patients who we are sending for stress tests, it seems pretty clear that invasive management is not beneficial, but does expose patients to harms. Therefore, assuming that you are going to have patients follow up with primary care for risk factor modification and medical management no matter what, there doesn’t seem to be any mechanism through which stress testing could possibly help”
Justin Morgenstern, First10Em – Stress Tests Part 4: Revascularization and the Value of Stenting
For en dybdegående diskussion af dette anbefales First10Em: Stress tests – https://first10em.com/stress-test-evidence-intro/
Lav-risiko patienten i HEART pathwayen
Hvem er lav-risiko patienten i HEART-scoren?
A single undetectable hs-troponin after 3 hours of symptom onset or a delta 2-hr hs-troponin T <4ng/L plus normal serial ECGs and a HEART score of 0-3 rules out acute MI and lowers 30-day MACE to well below 1%, a threshold below which ancillary testing may cause more harm than benefit.
Det vil sige:
1: A normal ECG and a single undetectable hs-troponin drawn 3 hours or more after the onset of symptoms rules out MI at ED arrival in 1/3 of patients and portends a MACE <2%
2: Two-hour [i Stockholm 1 time] serial testing rules-out MI in 60% of patients, rules-in MI in 15% of patients, leaving only 25% of patients undifferentiated after a 2-hour ED evaluation. Delta 2-hour hs-troponin <4 nanograms/liter hs-troponin T portends a MACE <2% [i Stockholm 2 nanogram/L]
EmCases Ep 128 Low Risk Chest Pain and High Sensitivity Troponin – A Paradigm Shift
3: Hs-troponins in combination with a 0-3 score in the HEART pathway lowers the number of low risk patients from 40% to 10% and portends a MACE <1%
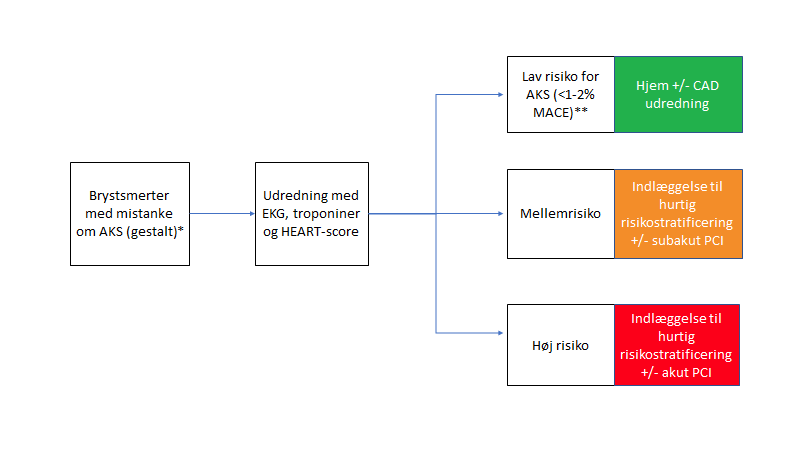
Så en patient vi bedømmer kan være AKS, men med normalt EKG, normale troponin(er) og som man har scoret med heart-pathwayen med score på <3-4 bør være færdigudredt på akutmodtagelsen?
Tja…Det kommer an på, hvor du arbejder
Nogle steder (bl.a hvor jeg arbejder), vil OMI udredningen gå over i udredning for CAD (coronary artery disease).
Arbejder du et sted, hvor egen læge følger op på “hjerte-raskhed spørgsmålet”, kan du springe understående over. For dig bliver spørgsmålet blot, hvad du skal sige til patienten når udredningen er slutført, og resultatet er, at patienten er i lav-risiko for AKS.
For dig, er det vigtigt at patienten ved følgende:
Just because the patient doesn’t have an MI, doesn’t mean they have a healthy heart
Em Cases Ep 128: Low risk chest pain
Patienten kan altså have CAD stadig, og kræve udredning via kardiolog eller egen læge. Hvor stor er patientens risiko for CAD? Denne er nyligt blevet nedjusteret ifølge ESC (european society of cardiology), 2019
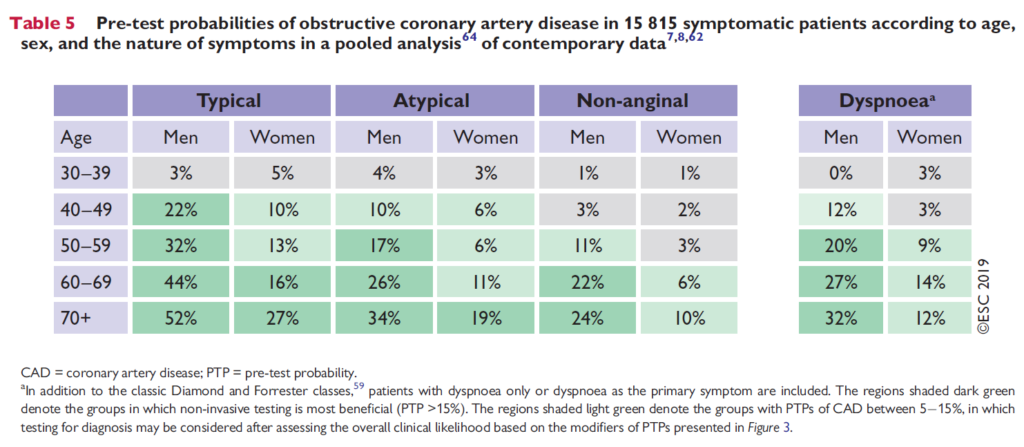
management of chronic coronary syndromes
Lignende tabel kan findes på cardio.dk under “stabil iskæmisk hjertesygdom”
Hvad er patientens risiko for fremtidig AKS, når man har CAD spørger du måske? Hvor hurtigt skal patienten udredes? skal de opstartes i behandling allerede fra akutmodtagelsen?
Dette første af disse spørgsmål er et af de mest centrale spørgsmål i kardiologien, og det er bestemt ikke afklaret. Resten af denne blog handler om dette emne. Del 5 tager afsæt i denne diskussion, men kan læses selvstændigt, da det er almengyldigt om al overbehandling og overdiagnostik.
Det kan være af interesse for dig på danske akutmodtagelser, uanset, da du også får disse spørgsmål fra patienterne.
CAD Vs OMI
Problemet kan kort forklares således: Er det hospitalets / akutafdelingens pgave, at udrede for CAD, når OMI er udelukket (under en acceptabel miss rate)?
For at kunne svare på dette, må vi dykke lidt dybere om forskellen mellem OMI/NOMI og CAD, end i del 3, hvor vi kort nævnte CAD (coronary artery disease)
Inden vi dykker ind, skal vi lige pause, og tydeliggøre:
- OMI: er en langt oftest akut opstået symptomgivende okklusion af koronarkar, der beviseligt har fordel for patienten at tage bort indenfor 12 timer fra symptomstart (jf PCI kriterier)
- CAD (coronary heart disease): er anatomiske plaques i koronar-karvæggen, der evt er symptomgivende
Men begge ting, obstruerer jo et kar til hjertet. Er der forskel??
JA!
…men det er kort sagt kompliceret.
Jeg bevæger mig i det følgende ind på et territorie, som jeg ikke fuldt har styr på, og man må tage de kritiske forbehold, der kræves af dette. Desuden er dette område et minefelt af interessekonflikter, patientorganisationer, det som John Brodersen kalder “popularity paradox” (se del 5) og samtidig noget big-pharma har været interesseret i næsten ligeså længe de har eksistereret.
Jeg føler alligevel, at jeg er nødt til at tale om dette for komplethedens skyld, da jeg dagligt konfronteres med denne patientgruppe, og bedes indlægge en lav risikogruppe for AKS til udredning for CAD.
Jeg anvender i det følgende, disse kilder
- Dr Rothberg, 2013: Coronary Artery Disease as Clogged Pipes A Misconceptual Model
- Clevelanclinic, 2018: PCI for Stable Angina: A Missed Opportunity for Shared Decision-making- take-home points from Michael B. Rothberg, MD, MPH
- John Mandrola, 2018 – Medscape: When Evidence Doesn’t Persuade: The Clogged-Pipe CAD Analogy
- Uptodate (tilgået december 2019): Clinical use of coronary artery pressure flow measurements
Og jeg anbefaler desuden følgende kilder til dette afsnit også
- Stress-test bloggen fra First10Em
- The OMI manifesto
Og cardio.dk samt ESC guidelines fra 2019, er ligeledes vigtige grundkilder i danske sammenhænge.
Jeg skal forsøge at forklare på bedste vis:
Jeg tror den bedste måde at starte dette på, er ved at tænke på det en KAG/PCI operatør ser: et koronarkar med en klot (plaque)
Har I fulgt mine blogs, vil I vide, at et sådant fund aldrig kan fortolkes uden en viden præ-test sandsynligheden (hvorfor får den her patient udført en KAG?) – men lad os gemme det, indtil videre, og dykke ned i, hvad vi egentlig ser på, på en KAG eller CT angiografi: plaques.
Er OMI én eller to modeller?
Vi er vante med modellen, der beskriver plaques som en såkaldt “clogged pipe analogi“: koronar-karene bliver tættere og tættere indtil de lukker helt til. Ud fra denne analogi er patofysiologien bag OMI, at CAD langsomt lukker lumen til, indtil en OMI opstår. Dette er nok kun i et fåtal af tilfælde, at dette er sandt
The clogged pipe analogy of stable coronary heart disease has been particularly difficult to dislodge.
Rothberg, 2013 Coronary Artery Disease as Clogged Pipes – A Misconceptual Model
According to this model, cholesterol plaques in the arterial walls slowly encroach on the lumen, causing silent ischemia first, then angina, and eventually infarction. Diagnosis begins with physiologic stress testing, looking for supply–demand mismatch, and progresses to angiography to find blockages. Treatments based on this theory include both coronary bypass and angioplasty, the latter often explained to patients as a Roto-Rooter or in the case of the magazine ad, as a Rotablator. Results of such revascularization procedures are visually striking and, in stable disease, may lead to the erroneous conclusion that the plumbing problem has been fixed and the risk of myocardial infarction ameliorated
Som Dr Rothberg beskriver, så er alle plaques ikke skabt lige. Det er det vi i dag kalder “stabile plaques” og “ustabile plaques” (ikke nødvendigvis at forveksle med stabil og ustabil angina – selvom der kan være overlap)
At en patient har CAD differentierer ikke mellem om vedkommende har stabile- eller ustabile plaques. Marathonløbere får med andre ord, også AKS, og (kendte) klassiske risikofaktorer betyder nok ikke alverden i akutmedicinske sammenhænge (jf del 1 og Simon Carley – Do Risk factors, factor?). Som Simon Carley nævner, så kender vi ikke de risikofaktorer, vi ikke kender – og de er måske mindst ligeså vigtige.
Not all plaques are equally likely to rupture. Stable plaques tend to be long-standing and calcified, with a thick fibrous cap. A stable plaque causing a 95% stenosis may cause symptoms with exertion, but it is unlikely to cause infarction. Conversely, rupture-prone plaques may cause little stenosis, but a large and dangerous plaque may be lurking beneath the thin fibrous cap.
Relying on angiography can be misleading. Treating all significant stenoses improves blood flow, but does not reduce the risk of infarction, because infarction most often occurs in areas where the lumen is not obstructed. A plaque causing only 30% stenosis can suddenly rupture, causing thrombosis and complete occlusion
Rothberg 2018, PCI for Stable Angina: A Missed Opportunity for Shared Decision-making- take-home points
Modellen med “clogged pipe” er altså mindre præcis til at forklare stabil koronarsygdom for patienter (da de tror, at fjerne store visuelt skræmmende flow-limiterende stenoserne hjælper dem for at forhindre OMI). Når en ustabil plaque rumperer vil det dog skabe “blokade” som en clogged pibe, men vejen dertil er dårligt forklaret af “the clogged pibe model”. Plaques skal i stedet ses som en dynamisk process, i stedet for en statisk og progressiv process. Rothberg foreslår i stedet en model der forklarer plaques som eksploderende bumser (pimples):
Doctors could begin by explaining that coronary artery disease [CAD], whether diagnosed by angiography or stress testing, is an inflammatory disease in which cholesterol from the blood is deposited in artery walls, causing an inflammatory reaction, like a pimple. When those pimples pop, they cause the blood in the arteries to clot at the site. If the clot closes off the entire artery, that causes a heart attack, and emergent medical attention is required to remove the clot. Thus, for patients who have coronary disease, it is crucial to take steps to reduce the inflammation, including both evidence-based lifestyle changes (smoking cessation, exercise, stress reduction, and a Mediterranean diet) and taking medications that reduce inflammation and prevent thrombosis (aspirin and statins). Doctors should state plainly that for preventing heart attacks, these are the only effective measures. If patients have ischemic symptoms (many do not), then they can be told that old plaques, liked scarred old pimples, may partially obstruct arteries and cause symptoms and that these symptoms can be relieved with medications. If the symptoms persist despite maximal medical therapy, patients could be offered PCI to relieve those symptoms.
Rothberg, 2013 Coronary Artery Disease as Clogged Pipes – A Misconceptual Model
Mindre stenoser af instabile plaques, er oftest dem, der skaber OMI når de eroderer eller rumperer. Disse plaques kan ikke sikkert skelnes på en KAG – og selv hvis de kunne, så er PCI ikke løsningen på dem, hvis de ikke lukker lumen til
Before rupture, these [ustabile] plaques often do not limit flow and may be invisible to angiography and stress tests. They are therefore not amenable to percutaneous coronary intervention (PCI)
Despite this overwhelming evidence, the plumbing model [clogged pibe model], complete with blockages that can be fixed, continues to be used to explain stable coronary disease to patients, who understandably assume that PCI will prevent heart attacks
[… ] One explanation for this [iblandt læger] persistent skepticism is that clinicians and investigators, working from an outdated conceptual model, have mistakenly focused on improving the technology for keeping open flow-limiting lesions, believing that better stent would eventually yield a mortality benefit in stable disease. The inflammatory disease model makes clear that such attempts are doomed to fail because vulnerable plaques cannot be identified or stented before rupture. Rothberg, 2013 Coronary Artery Disease as Clogged Pipes – A Misconceptual Model
ESC beskriver dog også følgende i deres nyeste guideline om CAD
CAD is a dynamic process of atherosclerotic plaque accumulation and functional alterations of coronary circulation that can be modified by lifestyle, pharmacological therapies, and revascularization [revaskularisering af CAD er kontroversielt – jf Justin Morgensterns gennemgang af litteraturen], which result in disease stabilization or regression
2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes
De store og stabile plaques hører formentlig oftest til en anden gruppe, der muligvis kan give patienten symptomer, og indikere behovet for best medical treatment. Men risikoen for en OMI pga demand (altså et type II infarkt) sekundært til et lille lumen, er lille, og ikke sådan vi forstår majoriteten af OMI
“Most ACS [OMI] result from the loss of integrity of the protective covering over an atherosclerotic plaque ”
Uptodate 2019 – Mechanisms of acute coronary syndromes related to atherosclerosis
Although some will argue that myocardial infarction [OMI/NOMI] can also occur at the site of flow-limiting stenoses, mathematical models suggest that these lesions contribute relatively little to modifiable risk.
Rothberg, 2013 Coronary Artery Disease as Clogged Pipes – A Misconceptual Model
De store stabile plaques er altså lidt som forandringer på en MR af ryggen (Brinjikji et al, 2015: Systematic Literature Review of Imaging Features of Spinal Degeneration in Asymptomatic Populations). De er mere end noget andet ”Alderstegn”. For nogle er ”alderstegnene” selvfølgelig betydeligt forhastede pga kendte og ukendte risikofaktorer (https://www.stemlynsblog.org/the-future-of-diagnostics-stemlynslive/ ), og derfor kan nogle – selv i en tidlig alder – have behov for profylaktisk risikoreducerende behandling.
Og lidt som en MR af ryggen kan undersøgelsesresultatet skræmme patienten, hvis de ikke grundigt informeres om resultatet kliniske betydelse. Og yderligere for at følge analogien med MR og ryg til dørs, så er invasive procedurer sjældent noget der er nødvendigt, hvis patienten ikke har helt særlige symptomer / fund.
Bottom line: Alle plaques er ikke skabt lige. De (ustabile) plaques der giver OMI, kan ikke visualiseres på CT angiografi og KAG (endnu) – og hvis de kan, så kan de ikke sikkert skelnes fra stabile plaques. Modellen om OMI som følge af plaques der vokser indtil lumen lukker til (the clogged pipe model), udgør en minimal – hvis nogen – del af OMI’erne. Majoriteten af OMI’er sker pga plaque ruptur / erosion, og kan ikke i dag forebygges ved PCI indgreb. Best medical treatment til CAD, er derimod det vi ved, der har effekt.
Hvordan ved jeg, om patienten foran mig i akutmodtagelsen har stabile plaques, instabile plaques eller noget helt tredje?
Så det kan virke som om vi går i ring hér. Det er muligt det bare er mig, men til trods for alt det vi ved og til trods for alt herover, så synes jeg ikke vi altid handler logisk på akutmodtagelsen ud fra det vi ved.
Anamnesen, objektiv undersøgelsen, HEART-scoren, TnI og EKG er det, der er vores tests for at skelne mellem om patientens symptomer kommer fra stabile eller instabile plaques (eller noget tredje).
Så når relevant udredning er udført, og patienten kategoriseres som lav-risiko, så er de lav risiko for at dette er en OMI (MACE 0,7-1,9% – men i realiteten formentlig 1:500 ud fra Justin Morgensterns analyse af Pope’s studie fra 2000), og den risiko går ikke at justere yderligere i den akutte setting.
Just because the patient doesn’t have an MI, doesn’t mean they have a healthy heart
EmCases Ep 128: low risk chest pain
En lav OMI-risiko i øjeblikket garanterer ikke hjertesundhed eller koronarkar uden plaques – det garanterer ikke heller, at smerterne kommer fra hjertet (jf del 5). Vi kan blot sige, at patientens symptomer sandsynligvis ikke relaterer til OMI! (dvs for praktiske formål – plaque ruptur). Derfor kan patienten med negativ OMI udredning stadig have behov for udredning via egen læge for CAD alt efter risikoprofil – men dette kan vente! (hvor længe det kan vente er således det springende spørgsmål – arbejder du et sted med opfølgning indenfor nogle uger, så er det formentlig sikkert)
Dette er skillelinjen imellem forebyggelse, og akut behandling, som visse hospitaler / regioner / lande træder over – med det resultat, efter min mening, at patienten overdiagnosticeres- og overbehandles i den (falske) tro om at “mere udredning / behandling er bedre”.
Grænsen mellem kort-tids risiko og langtidsrisiko
Nogle patienter med CAD er i større risiko end andre for fremtidig AKS. Hvordan finder vi dem, der er i større risiko? Og hvor nær / stor skal denne risiko værre før en indlæggelses-udredning er påkrævet hvis der ikke er påvist myokardieskade med troponiner?
Der findes en særlig skillelinje imellem akutmedicin og ambulatore / almen praksis – som dog er dynamisk og op til åben debat. Efter min erfaring og hvad der bl.a fortælles om i litteraturen på området, så afhænger graden af “almen praksis / ambulatorie arbejde” på akutmodtagelsen stærkt af tilgængeligheden for patientens mulighed for tidseffektiv udredning og opfølgning.
På nogle hospitaler (bl.a mit i Sverige, og flere i Canada og USA), griber overdiagnostik og overbehandling ind (bl.a forklaret ud fra, at der ikke er mulighed for opfølgning i samme grad som i Danmark) og dikterer, at lav-risiko grupper fra akutmodtagelsen skal have udført ”nogen test” under en indlæggelse, for at risikostratificere disse lav-risikogrupper uden tegn til OMI (Jeg vil undlade at tale om crowding problemer og risikoen for andre patienter, når vi skal udføre opgaver, som ressourcer på akutmodtagelsen ikke er til. Her fokuseres kun på den individuelle patient)
Jeg skelner i det følgende imellem POEM (patient oriented evidence that matters – dvs død eller alvorlig morbiditet) eller fund af anatomiske læsioner (dvs CAD). Bemærk, at disse tests ikke nødvendigvis er ubrugbare i andre grupper end akutmodtagelsens lav-risiko gruppe (jf fagans nomogrammet i del 1). Evidensen er kompliceret, og et eksempel på indication creep (jf neurobloggen i bunden) – metoder med evidens fra én setting, extrapoleret til andre settings / indikationsområder uden studie-validering.
Test-værktøjskassen er:
- Stress tests løbebånd / cykel (data fra First10EM)
- Stress EKKO
- Stress myokardieskintigrafi
- CT angiografi af hjertets kar
Disse tests har følgende accuracy (kilde: https://first10em.com/stress-test-accuracy/ + https://first10em.com/ccta-evidence/ )
- Løbebånd / cykel stress test
- For mortalitet / morbiditet (POEM): Dårlig evidens – den evidens der findes tyder meget tydeligt på, at de IKKE kan forudsige OMI eller død (Sensitivitet oftest 0%, og specificitet lav)
- For anatomisk okklusion (CAD): Når CT angiografi anvendes som guld-standard, har løbebåndstest en sensitivitet på 45% og en specificitet på 85% sv.t LR+ 3,0 og LR- 0,65)
- Stress EKKO
- For mortalitet / morbiditet (POEM): manglende evidens
- For anatomisk okklusion (CAD): Når CT angiografi anvendes som guld-standard, har stress EKKO en sensitivitet på 70-87% og specificitet på 72-77% sv.t LR+ 2,5-3,78 og LR- 0,17-0,42
- Myokardieskintigrafi
- For mortalitet / morbiditet (POEM): manglende evidens
- For anatomisk okklusion (CAD): Når CT angiografi anvendes som guld-standard, har myokardieskintigrafi en sensitivitet på 83% og specificitet 77% med moderat brede 95% CI. Dette svarer til LR+ 3,56 og LR- 0,22
- CT angiografi
- For mortalitet: ukendt / ingen data
- For anatomisk okklusion (CAD): Når sammenlignet med KAG (koronar angiografi) hos lavrisiko patienter, findes en sensitivitet 95-99% og en specificitet på 64-90% med variation i specificitet over studierne.
Dette er ESC’s egen oversigt – bemærk de ikke har mortalitet som ouctome, men hhv anatomisk CAD (venstre) og FFR-signifikant CAD (højre) (hvilket – igen – ikke nødvendigvist er en meningsfuldt outcome for patienten)
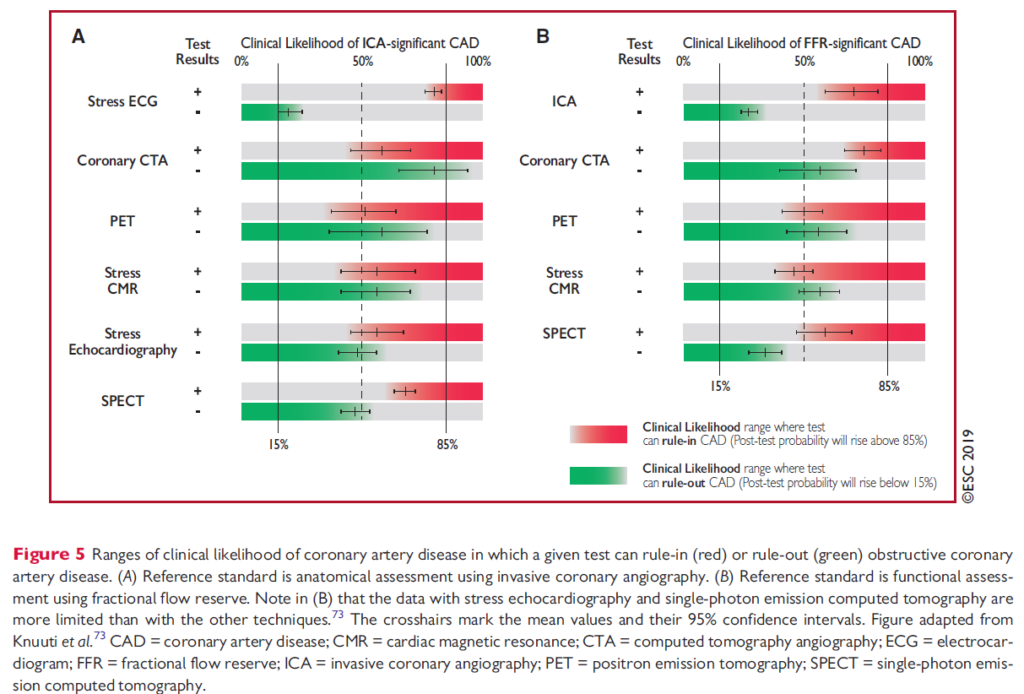
Der er flere problemer med at anvende overstående tests i lav-risiko patientgrupper
- Præ-test sandsynligheden: Når vi anvender tests på lav-prævalente grupper kan vi betragte det som screeninger (med de problemer screeninger medfører). Screeninger er i sig selv kontroversielle, og selv meget stærke screeningstest (som overstående tests på ingen måde kan siges at være) har den inherente risiko at føre til enormt mange falsk positive og falsk negative (jf gerne publikationer af John Brodersen) – med psykologisk og fysisk skade til følge. På en akutmodtagelse i en gruppe, som er blevet diagnosticeret som lav-risiko for OMI, vil disse tests altså ikke have nogen betydningsværdig udredningsværdi for OMI, og helt sikkert føre til unødige falsk positive KAG’er og PCI’er (for ikke at tale om somatisering af patienten). Dette er fint illustreret via FIRST10Em Justin Morgensterns post om stress-tests:
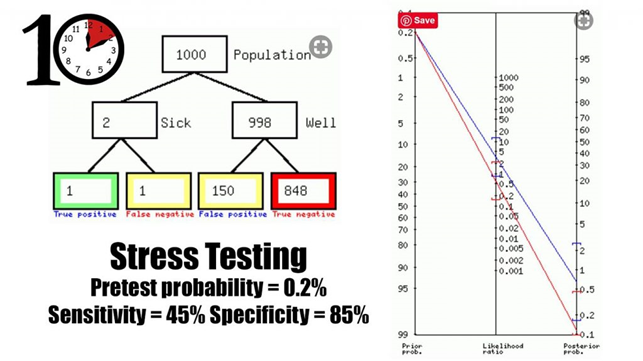
0,2% præ-test sandsynlighed kommer fra First10Em’s re-analyse af Pope et al, om hvor mange OMI’er vi misser efter endt relevant work-up i akutmodtagelsen med klassificering af patienten som “lav risiko”.
Sensitivitet og specificitet er First10Em’s samlede statistiske accuracy ud fra analyse af konventionelle løbebånd/cykel stress tests sv.t LR+ 3,0 (blå linje) og LR- 0,65 (rød linje)
Bemærk take-home pointen om stress test af lav-risiko grupper på akutmodtagelsen for at diagnosticere OMI: De ændrer IKKE nævnværdigt ved post-test sandsynligheden, og der derfor rent medicinsk irrelevante i denne setting (om patienten psykiske ro er værd at købe for potentielle falsk-positive, er den samtale man må have med patienten om de bestilles)
Fra First10Em: stress tests
- CAD er ikke det samme som OMI: Stress tests og diagnostiske tests er gode til at finde anatomiske læsioner. Mange patienter uden okklusion >50% får OMI (jf “pimple”-modellen Vs “clotted pipe”-modellen). Er det meningen, at vi skal udrede patienten med stress tests, så skal det gøres ud fra et almen praksis perspektiv, og man må tage ”nogle helt andre briller på” ift risikovurdering og risk-benefit (jf også Rothenberg 2018)
- Revaskularisering af CAD er ikke det samme som behandling for OMI: (falsk)positive stresstests og CT angiografi på patienter med lav risiko for OMI ud fra HEART-pathwayen (og dem med non-OMI UAP/NSTEMI), giver oftest ophav til KAG, som giver ophav til PCI. Ifølge First10EM (https://first10em.com/revascularization-evidence/ ), så er revaskularisering særlig af CAD (for ikke at tale om lav risiko UAP/NSTEMI), kontroversielt og under ingen omstændigheder en akutmedicinsk opgave, men en beslutning der bedst tages i en ikke-akut setting via kardiolog / almen praksis ud fra risiko vurdering. Selv i denne setting er det fortsat forholdsvist kontroversielt, hvem der skal behandles med invasiv udredning og tests.
- Symptomlindring argumentet: jf herunder
Det er for patienternes bedste, at vi ikke udreder videre ”bare for en sikkerheds skyld” på patienter vurderet som lav post-test risiko i akutmodtagelsen (som generel tommelfingerregel) – vi taler sjældent om de skader der induceres af falsk positive, overdiagnostik og psykologiske besvær, men de er af enorm vigtighed for patienten. Det gælder ikke bare AKS udredning, men al slags udredning:
I frequently hear stories of “great catches”. Of doctors who ordered a CTPA, despite the patient being low risk for PE and PERC negative. Low and behold, the CT is positive. The doctor widely brags about this great save. Residents are taught about the fallibility of the PERC rule, and ultimately more CTs are ordered
After an appropriate patient is ruled out by the PERC score, she has approximately a 1.4% chance of PE. (Kline 2004) A CT pulmonary angiogram is a pretty good test, although I have previously discussed data demonstrating that radiologists often disagree about the final read. (Miller 2015) The best data we have probably comes from the PIOPED II study, which found that a CTPA has a 83% sensitivity and 96% specificity when compared to traditional pulmonary angiography. (Stein 2006) CT technology has changed since the PIOPED study, and so the sensitivity is almost certainly better (but I had a very hard time finding a modern estimate). For the sake of our calculations, I will just assume a 95% sensitivity.
Thus, for every 1000 low risk PERC negative patients seen in the ED, there will be 14 PEs. CT will catch 13 of these 14 patients. For the remaining 986 patients, CT will be falsely positive in 39. Therefore, the CT will be positive in 52 total patients, but only 13 of these patients (25%) actually have a PE.
So when a colleague brags about finding a PE in a low risk, PERC negative patient, there is a 75% chance they are wrong. There is a 75% chance that the patient has been given unnecessary anticoagulantion. A 75% chance that, although the CT was a false positive, the patient will rush to the emergency department for any chest pain or shortness or breath for the rest of her life, getting many more tests (and potentially more false positives). In other words, there is a 75% chance we are hurting this patient.
You can’t interpret the results of a test without knowing the pretest probability.
This is true of all our tests. Whether you are ordering a CT, a blood count, an x-ray, or an ECG. You can’t interpret the results of a test without knowing the pretest probability. Trying to do so will hurt your patients
First10Em (https://first10em.com/why-pretest-probability-is-essential/ )
Overstående er ikke ment som et ønske om mindre work-load (selvom vi helt klart også kan tale om den del ? – jf Arbejdsmiljødokumentet fra YDAM 2018 og DASEM 2019).


vi bestiller undersøgelser først, og vurderer først bagefter om de er brugbare. Kommer der positive resultater, må vi forklare det til patienten og bedømme det ud fra præ-test sandsynligheden. Dette er ikke umuligt, men leder til unødige undersøgelser og ofte overbehandling (hvor mange gange har du bestilt en CT thorax pga en positiv D-dimer bestilt fra triagen?)
Og hvad så hvis nogen får en ekstra PCI?
Vi gemmer den, efter min mening, vigtigste del af denne diskussion til del 5 (somatisering, psykologisk byrde, misser hvad patienten egentlig kommer for / early diagnostic closure etc).
Her kan vi blot fortælle, at KAG formentlig har minimal risiko (cardio.dk beskriver 1 promille risiko), men PCI ikke har det – særligt ikke, hvis vi er udenfor den elektive setting:
The worst complications of coronary angiography are coronary dissections and perforations, which generally only occur from the actual coronary intervention rather than the diagnostic portion of angiography. However, all patients who undergo emergent coronary angiography (even the false positives who do not receive PCI) receive the following risks: early diagnostic closure (with possible harms depending on the actual missed/delayed diagnosis), arterial punctures with bleeding complications such as groin or retroperitoneal hematomas exacerbated by loading with multiple antiplatelet and anticoagulation drugs, contrast associated nephropathy [red: denne risikofaktore er negligabel og formentlig ikke-eksisterende – jf EmCases journal jam 11], large cost and resource mobilization
The OMI manifesto, 2018
PCI entails a small but not inconsequential risk. During the procedure, 2% of patients develop bleeding or blood vessel damage, and another 1% die or have an MI or a stroke. In the first year after stent placement, 3% of patients have a bleeding event from the antiplatelet therapy needed for the stent, and an additional 2% develop a clot in the stent that leads to MI.
Rothenberg 2018 – PCI for Stable Angina: A Missed Opportunity for Shared Decision-making- take-home points
Risikoen for større komplikationer ved PCI er beskeden og varierer med grundmorbus og koronaranatomi, ligesom risikoen ved akut intervention naturligvis er større end ved elektiv behandling.Risikoen for død 30 dage efter elektiv PCI er ca. 0,4%
Cardio.dk – Stabil iskæmisk hjertesygdom, tilgået nov 2019
Så kan vi gå ind i et kar (KAG), og vurdere, at plaques ikke kræver PCI, for dernæst at gå ud igen – hver gang – så er der ikke sket nogen stor skade (andet end stråling, og en procedural / kost-mæssig byrde for systemet og patienten). Men når man går ind i et abdomen, og er i tvivl, fjernes appendix ofte. Det er mit indtryk, at af forskellige årsager (som ikke er ulogiske / uforståelige), vælges ved tvivl at udføre PCI (med de risici der er forbundet hermed).
Man har indenfor KAG teknologien forsøgt at diagnosticere særligt højrisiko CAD-læsioner, der er flow-limiterende med forskellige visuelle (plaque udseende) og dynamiske teknikker – FFR (fractional flow reserve). Jeg er ikke dykket helt ned i denne litteratur, men så vidt jeg kan se via uptodate, så er dette endnu ikke fuldt en valideret morbiditet / mortalitet reducerende teknik, og der mangler større prospektive RCT’er for at kunne give os et svar på dette. ESC 2019 bygger dog deres nye guideline på, nyere metaanalyser, og mener revaskularisering skal udføres med bredere indikation:
In contrast to some of the earlier meta-analyses, this signal was confirmed in a patient-level meta-analysis including 2400 subjects, all of whom underwent invasive physiological guidance, showing a significant reduction in cardiac death and MI after a median follow-up of 33 months with FFR-guided PCI vs. medical therapy (hazard ratio 0.74, 95% CI 0.560.989; P=0.041. Together, these new data support a less restrictive indication for revascularization in CCS, in addition to specific anatomy or extended ischaemia (>10%), when PCI is restricted to angiographic stenoses on large vessels causing a significant intracoronary pressure gradient
2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes
Jeg vil igen pointere, at vi hér taler om lav-risiko patienter ifølge HEART-pathwayen – det er patienter uden EKG forandringer i hvile, og uden troponinslip. UAP patienten er i denne sammenhæng og ud fra diskussionen i del 3 altså kategoriseret som en lav-risiko patient for OMI (men ikke for CAD). Moderat-risiko patienterne er en ekspert vurderingssag, og en anden snak (omend evidensen som beskrevet i del 3 er begrænset for revaskularisering af denne gruppe også)
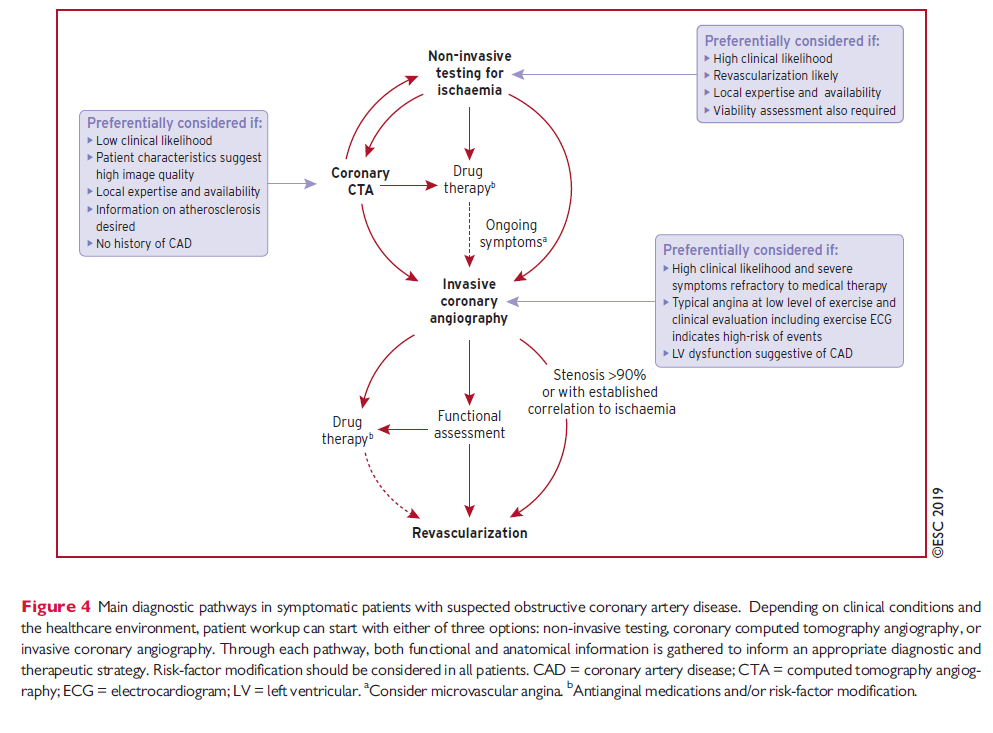
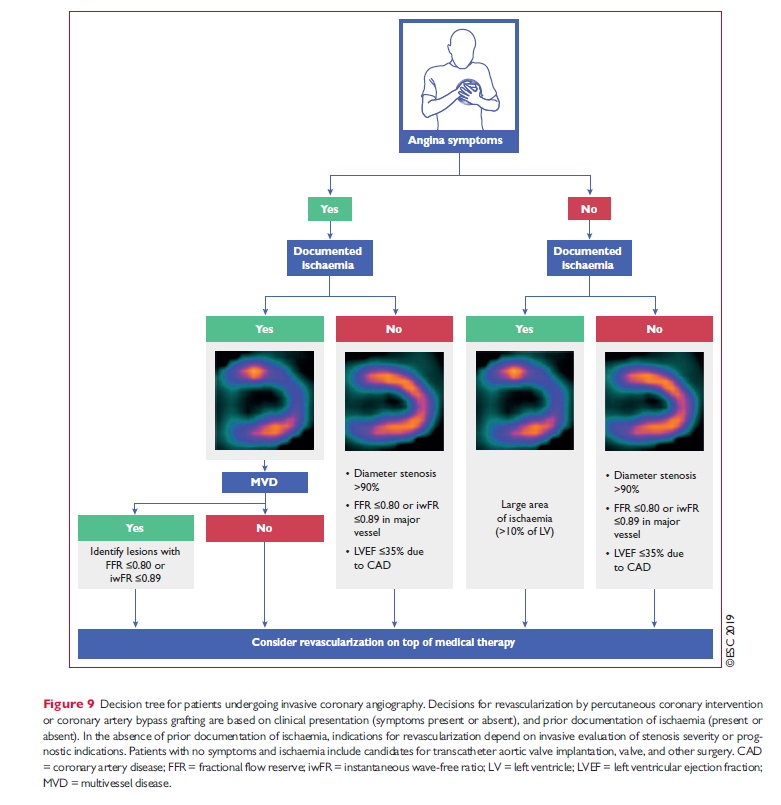
ESC 2019 foreslår følgende udredningsalgoritmer
Hvad med symptomlindring og psykisk aflastning for patienten?
Dette synes jeg måske er et af de mest relevante spørgsmål, som ofte overses.
Hvis vi er bekymrede for den psykiske påvirkning af patienten, må vi for det første gøre mere ud af informations-delen og risk/benefit forklaringen for dem – på et sprog de forstår (jf bl.a Rothberg 2018). Desuden bør vi begynde at tale med dem om den eksistentielle angst, som ikke kan fjernes ved nogen mængde medicinske procedurer – i stedet for at forsøge at stille pseudodiagnoser. Risikoen for en undersøgelse eller behandling “bare for en sikkerheds skyld” eller for “psykisk tryghed” skyld, kan have store down-stream konsekvenser for patienten:
(falsk)positiv test “for sikkerheds skyld test” -> CT angio -> tvivl, angst, avoidance og lidelse -> KAG -> PCI
For symptomlindringsdelen hos folk der ikke har multi-kar sygdom, så begynder der også at komme flere og flere søm i den kiste efter Orbita-studiet fra 2018
A more recent study has raised the possibility that the improvement in angina with PCI is primarily a placebo effect. Researchers in the United Kingdom randomized patients with stable angina and at least a 70% stenosis of one vessel to either PCI or sham PCI, in which they threaded the catheter but did not deploy the stent. All patients received aggressive antianginal therapy before the procedure. At 6 weeks, there was improvement in angina in both groups, but no statistically significant difference between them in either exercise time or angina. Approximately half the patients in each group improved by at least 1 grade on the Canadian Cardiovascular Society angina classification, and more than 20% improved 2 grades
Rothberg 2018 – PCI for Stable Angina: A Missed Opportunity for Shared Decision-making- take-home points
ESC skriver om ORBITA-studiet:
The study highlights a significant placebo component to the clinical effects, and alerts us to the pitfalls of interpreting endpoints subject to bias in the absence of sham control and blinding. However, the ORBITA results cannot inform Guidelines due to the limited trial size, short-term observation time until crossover, and insufficient power to assess clinical endpoints
2019 ESC Guidelines for the diagnosis and management of chronic coronary syndrome
Jeg fortsætter denne diskussion i del 5 – om den psykiske/mentale og sociale konsekvens ved at udføre potentielt unødige tests på patienten.
Bagsiden af medaljen, som vi sjældent taler systematisk om, hverken iblandt hinanden eller til patienten.
Opsummerende bottom line:
HEART-scoren
- HEART scoren kan effektivt anvendes og er eksternt valideret i studier fra udlandet
- I Danmark er vi ganske unikke: Vi har måske en population i akutmodtagelsen, der er højere risiko (higher acuity) end noget andet sted i verden pga vores velfungerende primær-sektor triage system (almen praksis). Derfor skal al data fra udlandet (hvor de har lavere acuity populationer i akutmodtagelsen) – dette gælder også HEART-score-pathwayen – kritisk valideres i vores population inden man kan anbefale den.
- Det er muligt, at HEART-pathwayen dog alligevel kan anvendes i Danmark, da brystsmertepatient populationen på danske akutmodtagelser ligner den udenlandske, fordi sundhedsstyrelsen ønsker, at næsten alle brystsmertepatienter udredes på en akutmodtagelse
Lav risiko patienten – OMI Vs CAD
- Patienten i akutmodtagelsen med brystsmerter, søger vi at udelukke OMI på. Uanset hvilken metode man anvender til dette, vil post-test sandsynligheden sjældent kunne falde til mere end <1-2% MACE
- MACE er et compound outcome, der består af død og MI, som kan kaldes POEM (patient oriented outcome that matters), og den mere kontroversielle “revaskularisering”
- “Revaskularisering” er kontroversielt, da majoriteten af studier på området ikke har vist nogen overbevisende overlevelse eller morbiditetsfordel, for andet end STEMI (OMI) patienten.
- For lav risiko brystsmerte patienten i akutmodtagelsen, som ikke har troponinslip eller akutte iskæmiske forandringer, bør en ambulant opfølgning foretages, hvis man har mistanke om CAD (coronary artery disease) – “en normal AKS udredning garanterer ikke et normalt og sundt hjerte”. Hvilke patienter der skal udredes afhænger af risikostratificering, og dette er ikke en akutmedicinsk / indlæggelseskrævende opgave, som udgangspunkt. Undtagelser kunne hypotetisk være hvis ventetiden er urimelig lang for udredning (måneder), patienten har hurtigt progredierende symptomer (crescendo angina) eller patienten er ekstremt invalideret (psyko-social indikation for hurtigere udredning).
- OMI og CAD er formentlig to relaterede, men forskellige sygdomme: Vi har tidligere troet (og forklarer stadig patienten om), at det plaque man ser i et koronarkar, vokser og vokser indtil det tillukker koronarkaret og giver MI (myokardie infarkt) (the clogged pipe model). Denne model er misvisende, og udgør formentlig kun vældigt få tilfælde af MI. I stedet er de fleste MI skabt af ruptur af instabile plaques, som ikke er KAG-synlige og derfor ikke PCI-mulige!
Behandlingen for at reducere risikoen for plaque-ruptur er derfor best-medical treatment, snarere end invasiv behandling. Et ruptureret akut plaque, er det vi kalder et OMI, og dette er eneste sikkert evidensbaserede PCI-krævende behandling. Efter OMI udredning på akutmodtagelsen er altså tilbage de patienter, uden manifest myokardieskade, men mulig CAD (der igen, kun sjældent giver anledning til OMI, men muligt er korreleret med mængden af instabile plaques).
CAD – og hvem der skal revaskulariseres
- CAD skal i stedet forstås som en dynamisk inflammatorisk sygdom der går frem og tilbage – ikke en statisk. Når vi tidligere har troet, at PCI på alle plaques “åbnede op” og kurerede patienten, har vi altså haft fejl (uanset, hvor visuelt beroligende det må se ud). I stedet bør risikoreducerende behandling (særligt også non-farmakologisk motion- og diæt behandling) opprioriteres snarere end invasiv behandling i denne gruppe patienter.
- Nogle CAD patienter som allerede får best-medical treatment har muligvis gavn af revaskularisering, og KAG med FFR er måske en fremtidig metode til at skelne højrisiko CAD fra lav-risiko CAD. Ud fra begrænset gennemgang af litteraturen virker det dog stadig til, at der mangler tydeligere evidens for mortalitet- og morbiditet (POEM) fordele for patienten.
- Risikostratificeringen af høj- Vs lav-risiko CAD er et kontroversielt område, hvor der er høj risiko for somatisering- og overdiagnosticering. Det er i denne gruppe essentielt, at udføre SDM (shared decision making), og informere om NNT (number needed to tret) og NNH (number needed to harm).
- Revaskularisering på indikationen “symptomatisk lindring” ved CAD patienter med best medical treatment, er i det nylige ORBITA-studie i høj grad blevet
- KAG har formentlig minimal risiko (<0,1% patient-relevante komplikationer), men PCI har ikke-negligable risici (0,5-1% patient-relevante komplikationer). KAG med plaques hos lav-risiko brystsmertepatienten, som ikke bedømmes som høj-risiko plaques, skal bør derfor nok lades i fred, og behandles med best medical treatment i stedet (igen – dynamisk model i stedet for clogged pipe modellen)
- Da KAG ikke kan udføres på alle, må man med mindre invasive tests forsøge at tilnærme sig patientens risiko via stress tests, myokaridie skintigrafier og CT angiografier. Disse tests har generelt dårlig korrelation med PCI-relevante læsioner målt med FFR, og bør udføres efter grundig samtale med patienten (SDM) – ikke på en akutmodtagelse, og kun sjældent – hvis nogensinde – via indlægning. Der er med andre ord stor risiko for overdiagnostik og overbehandling.
Den psykiske komponent (se også del 5)
- Vi behøver i høj grad, at blive bedre til den psyko-sociale komponent af brystsmerter, som altid eksisterer i enhver smertetilstand, og hvordan vi som klinikere – både akutmedicinere, almen praksis og kardiologer – kan blive bedre til at give vel-balanceret information om risiko og fordele for biologisk komponent, samtidig med at vi informere om de altid tilstedeværende mentale og sociale del-komponenter (og optimalt set håndteringen af disse med samme alvorlighed, validering og empati, som biologiske komponenter)