“…where is the patient?…”
Monty Python (The Meaning of life)
Du er dér næsten. Lad dig dog ikke narre. Den sidste del af turen, er mindst ligeså vigtig
Ad 2 og 3 (cont): SPORT
Diagnostiske og terapeutiske thresholds (4, 6, 7, 10)
Vi kan nu endelig vende tilbage til thresholdmodellen. Vi forstår nu, at
En tests LR er som vægte, der fører sandsynligheden
for den specifikke diagnose nærmere eller fjernere de 100%
Og dertil at
Tests giver ikke mening uden præ-test sandsynligheden at gå ud fra
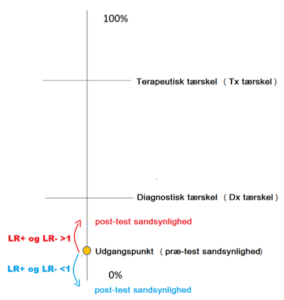
Vi kan nu gå videre til sidste del af modellen, som er tærsklerne (”thresholds”). Der findes to tærskler – en diagnostisk (ofte kaldet ”test tærskel”), og en terapeutisk tærskel. Den diagnostiske tærskel fortæller hvornår man mener sandsynligheden er høj nok til, at man vil ofre en test (fx D-dimer) for at ændre sandsynligheden. Den terapeutiske tærskel har samme effekt, blot for behandlingsinitiering. Bemærk, at der må være flere diagnostiske tærskler (da anamnestiske spørgsmål også er tests, før objektiv og før paraklinik – dette giver mening, da vi jo ikke spørger personer med ekstrem lav præ-test sandsynlighed om screeningsspørgsmål for fx porfyri. Spørgsmålet ligget med andre ord under tærsklen for de diagnostiske ”screenings” spørgsmål).
Når vi i akutmedicin beskriver den ”diagnostiske tærskel”, taler vi dog ofte om en specifik tærskel for at tage en særlig paraklinisk test, der vil rule in eller out (fx D-dimer og CT angio ved lungeemboli, Troponiner og EKG ved AKS m.m)
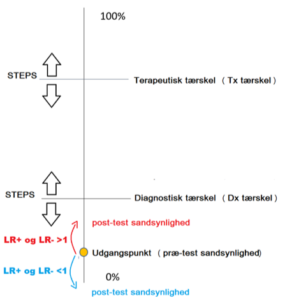
Det er ikke svært at forestille sig, at tærsklerne ikke er ens for hver sygdomsdiagnose, eller endda for hver patient. Med lidt fantasi kan der endda forestilles scenarier, hvor den terapeutiske og diagnostiske tærskel er meget nær hinanden (Fx tiamin og b-combin til mistanke om WE), meget fjernt fra hinanden (fx kraniektomi for SDH hos ældre) eller ligefrem ændrer plads (fx meningitis, hvor den diagnostiske tærskel for Lumbalpunktur ligger over den terapeutiske tærskel). Dette er delvist intuitivt for os. Men hvordan finder man ud af, hvordan tærsklerne bevæger sig ved en given sygdom i en given patient? STEPS er svaret:
| Sænker threshold (vi udfører hurtigere test / behandling | Øger threshold (vi udfører senere test / behandling) | |
| Severity of disease | Høj mortalitet / morbiditet, hvis ubehandlet (jf også diskussion herunder) | Lav mortalitet / morbiditet, hvis ubehandlet |
| Treatment tolerability / acceptability | Non- eller minimalt invasive test Ikke etisk problematisk Lille ”burden of treatment” |
Invasiv / ubehagelig test
Etisk problematisk Stor ”burden of treatment” |
| Effectiveness / Evidence of test (LR) and treatment (NNT) (good / bad?) | LR med stort impact, god evidens, samme population som patienten Lav NNT, behandling med god effekt på patientrelevante outcomes |
LR med lille impact, dårlig evidens, ulig population som patienten
Høj NNT, behandling med ringe effekt på patientrelevante outcomes |
| Price of test / treatment | Billig test / hurtig ikke tidskrævende test / laver ikke flaskehalse (høj cost / benefit) | Dyr test / tidskrævende test / giver flaskehalse (lav cost / benefit) |
| Safety / of test / treatment to patient | Få patient-relevante bivirkninger ved test / behandling | Mange patient-relevante bivirkninger ved test / behandling |
Man kan tilføje flere elementer til STEPS, men essensen bliver det samme. Ved at vurdere vores diagnose-tankegang ift STEPS kan vi forklare flere dagligdags ting: fx hvorfor vi tester relativt hyppigt med minimalt invasive, forholdsvist billige og ”gode” tests for at udelukke alvorlige sygdomme (fx EKG og TnI for AKS, eller CTc for SAH). På samme måde at vi på vid indikation bør give effektiv og bivirkningsfri behandling for alvorlig sygdom, på sygdomme der er usikre at diagnosticere (fx IV / intramuskulær tiamin / b-combin skal gives ved mindste mistanke om WE). Eller hvorfor pianisten med brækket håndled skal opereres hvorimod en dement plejehjemspatient formentlig ikke behøver det i samme grad. Eller hvorfor en diagnostisk metode kan være værre ift cost/benefit end den potentielle behandling (jf ALARA princippet ved traumeskanninger af børn – http://www.stemlynsblog.org/jc-trauma-paediatric-wbct/ ) – Et andet relevant værktøj ift radiologiske doser er skemaer som dette (https://www.radiologyinfo.org/en/info.cfm?pg=safety-xray ), som jeg har med i min lommebog. dette kan være særligt godt at gøre opmærksom på til vores population af psykosomatiske patienter med mange skanninger bag sig. Mange flere eksempler kan laves ud fra forskellige scenarier.
Vi kan nu fuldende vores threshold model:
I en perfekt verden fra et decision making perspektiv, havde vi, for alle typer præsentationer og illness scripts i vores (akutmedicinske, danske) population følgende data:
- Realistiske og lokale data om præ-test sandsynlighed
- LR+/- (eller CDR’s), sensitivitet og specificitet, samt kappaværdier (eller andet mål for IRR) for de vigtigste diagnostiske undersøgelser (med kvalitet som beskrevet i del 3)
- NNT for alle vores behandlinger på patient-relevante outcome, og visual aids der realistisk hjælper vores patienter til at træffe
Ad 4: SPORT
Det fantastiske ved threshold modellen, probabilistisk tankegang og LR’s, at det automatisk / logisk opfordrer til shared decision making med patienten hele vejen igennem dataindsamlingen. Uanset om vi regner risici ud (hvilket jeg ikke endnu kan anbefale jf del 3), eller anvender overstående metode som fingerpeg / overslag, vil vi ende med et cirka tal for risikoen for patienten for en given sygdom (eller indlæggelse Vs udskrivelse alt efter hvordan modellen anvendes). Og hvad patienten ønsker at løbe af risiko, er ikke noget vi som læger fuldt kan svare på. Vi er eksperter i vores, patienten eksperter i sit:
Risiko og shared decision making
Som mennesker, er vi ikke glade for usikkerhed (jf som enkelt eksempel fx diverse studier af Mary Ainsworth (strange situation), og John Bowlby (secure base teorien). Vi har et eksistentialistisk ønske om at være sikre – særligt sikker på, at der er en dag i morgen. Denne sikkerhed er der dog ingen, der kan give os (jf fx Satré om ”kastethed” og årsagen i form af vores eksistens går forud for vores essens (modsat fx saksen)), og vi er nødt til at rumme det som en livsforudsætning (i hvert fald for nu: CGP grey – https://www.youtube.com/watch?v=C25qzDhGLx8 , https://www.youtube.com/watch?v=cZYNADOHhVY eller Kurzgesagt: https://www.youtube.com/watch?v=GoJsr4IwCm4 )
Inden det bliver for højtflyvende skal jeg nok komme tilbage til pointen: Når patienter kommer til os med et ønske om ”forsikring”, så er det i sagens natur urealistisk. Vi kan i kommunikativt øjemed ofte udglatte denne forklaring og gå med patienten i, at sygdom er ”udelukket” / ruled out (men det vi i virkeligheden siger er, at den er usandsynliggjort) – Vi skal dog være opmærksomme på, at der hér er slags paternalisme (som dog ikke nødvendigvis er dårligt i alle tilfælde – jf senere kommunikations blog indlæg).
Hvorfor vi bør udføre shared decision making er en historie til en anden gang, men kort sagt, kan man sige, at det blandet meget andet øger compliance (adherence), giver bedre patienttilfredshed- og involvering, og patienters risk attitude og værdier (Atul Gawande: Being Mortal eller Bent Falk: At være der hvor du er) er ofte forskellig fra vores egen (jf fx dette nylig studie af Arrietta et al: https://onlinelibrary.wiley.com/doi/full/10.1002/hec.3628)
Hvad vil du som læge for eksempel være tilfreds med at sende patienten hjem med i risiko for at misse lungeemboli? 1/25? 1/50? 1/100? 1/1000? 1/10.000? – og hvad vil din patient? (det faktuelle svar for hvor langt vi kan banke den ned, er formentlig ca 1:50 jf (5) ). Hvad med SAH? ved CT skanning negativ <6 timer fortolket af neuroradiolog, fanger man 1:250 ekstra (selvfølgelig igen afhængig af præ-test sandsynligheden) (jf http://www.stemlynsblog.org/lets-talk-about-subarachnoid-haemorrhage/ )
Ofte ender vi endda ikke med så gode odds som 1:50, og vi ender i ”ingenmandsland” (mellem diagnostisk og terapeutisk tærskel) – og hér står vi ofte uden at vide, hvad vi skal gøre. Vi KAN ikke vide det selv – hér er det samtalen med patienten, og forklaring af muligheder, der er løsningen.
Ud fra en fuldstændig empirisk og subjektiv anbefaling, har jeg følgende tips (jf også fremtidigt indlæg om kommunkation) ifb denne samtale med patienten (jf også senere blogindlæg om kommunikation)
- Anvend altid sikkerhedsnet (i og med, at vi sender folk hjem med en risiko) fx efter følgende formler: http://www.stemlynsblog.org/communicated-discharge-safety-netting/ og https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2765844/ , OG i den forbindelse forklar om dem om den forventelige naturforløb (fx ved rygsmertepatienten uden røde flag: ”det er ikke farligt, det gør ondt, du skal bevæge dig til smertegrænsen – husk det er IKKE farligt, og de fleste er smertefri efter 6-8 uger, med klar forbedring efter 2 uger” – jf fx http://neurokirurgi.info/pdf/RygKompendium.pdf )
- Vær ikke bange for at tale om sandsynligheder direkte og indirekte ifb forventningsafstemning med patienten (fx vil jeg i behandlingsloft-samtalen med patienter ikke sige ”vil du genoplives”, men i stedet, vil du, at vi udfører et ”genoplivningsforsøg” – og vil herefter forklare om hvor mange i deres alder, der ville overleve med godt neurologisk outcome)(11).
- Pas på ”burden of treatment” ved ældre patienter (er opfølgningen værre end at lade være?)
- Vær opmærsom på, at din risk willingness ikke er det samme som patientens (erfaring viser, at patienter ikke ønsker helt så stor sikkerhed som vi vil)
- Pas på konceptet om risk proximity (jf http://www.stemlynsblog.org/risk-probability-decisions-emergency-medicine-st-emlyns/ ): som systemet er nu, kan det rigtigst at undlade at lave en undersøgelse som kan inducere cancer om 30 år – men du får måske en klage i morgen fordi du ikke skannede for at udelukke lungeemboli helt. Personligt mener jeg dette, fører til overdiagnosticering, samt skærer vores “lægelige skøn” væk. Vi bør så vidt muligt undgå dette med shared decision making.
- Ved svære beslutninger “Fly ahead of the plane” / lav tanke-træ-analyse (jf http://www.stemlynsblog.org/risk-probability-decisions-emergency-medicine-st-emlyns/ ) : gå et par skridt frem i den process du er i gang med (fx 90 årig dement plejehjemsbeboer med lavt funktionsniveau og nu med UL verificeret AAA >3 cm og mavesmerter.Skal vi udføre CT skanning? -> positiv CT skanning -> operation -> ITA +/- -> musclewasting -> genoptræning -> hjem Vs plejehjem). Hvad er sandsynligheden for succes? Hvad vil pårørende / patienten, og hvad er livskvalitet for patienten (Atul Gawande: Being Mortal og Julia Ragland (11)), og vil de kunne opnå dette med rimelig sandsynlighed?
- Informer patienten i et sprog de mest sandsynligt forstår – ofte er svaret NNT (jf theNNT.com), i stedet for RR
- UPDATE 2019: CAVEATS ved anvendelse af NNT
- Overvej visual aids når muligt (eller vær kreativ med pen og papir / computer / sten eller hvad ud har for hånden, når du ser patienten): I tilfældet om AKS, findes der ”visual aids” hvis man anvender HEART scoren (https://www.grepmed.com/images/379/shareddecisionmaking-patientinfo-decisionaid-cardiology-management-chestpain-umaryland ), som fasciliterer shared decision making. Dette findes også for andre tilstande (https://health.ebsco.com/products/option-grid).
Shared decision making er endemålet I vores tur igennem decision making delen. Der er flere områder af akutmedicin, hvor vi formentlig burde kigge på hvad patienten vil for at svare på vores ubesvarede spørgsmål / dilemmaer (triage: http://www.stemlynsblog.org/goldilocks-and-the-triage-system-what-are-we-really-seeking-with-st-emlyns/ ) .
Jeg vil slutte med en reference til et studie, jeg for nyligt fandt af akutmedicineren professer Rick Body fra Manchester (https://www.researchgate.net/publication/259456603_Not_all_suffering_is_pain_Sources_of_patients%27_suffering_in_the_emergency_department_call_for_improvements_in_communication_from_practitioners, der meget fint illustrerer et vigtigt budksab, som også findes i Reuben Strayers video fra del 1.
Vi må i vores decision making ikke glemme personen (jf STEPS) igennem hele forløbet. Folk er bange, har ondt og med et for lidt anvendt ord, vil man sige, at de ”lider”. Lidelse, er som smerte, subjektivt – vær altid opmærksom på ”det femte vital parameter” (smerte og smertestillende) (og det sjette og syvende ved ældre: walking and talking), og at god kommunikation ikke bare går hånd i hånd med decision making, men også lindrer lidelsen.
De følgende blogs vil være om kommunikation og ABCDE.
Tak (!!) fordi du gjorde alt det du har gjort, for at komme hertil!
Vi er ved slutningen af denne rejse. Bjergets top. Jeg kan ikke love, at strabadserne var det værd (sådan er det med rejser). Jeg håber dog at rejsen gav dig nogle ting du kan tage med.
Stedet vi er nu er ikke endemålet. Endemålet er måske ikke engang det, der er vigtigt – så længe vi prøver at bevæge os imod en bedre fremtid for os selv og vores patienter.
Om ikke andet, så håber jeg, at du har lært noget om en anden måde at tænke på, og herfra kan nyde udsigten over din egen vej hjem igen.