I første del talte jeg om problemet med grønne patienter i akutmodtagelsen set fra et overordnet perspektiv. I del 2 fokuserer jeg på det akutmedicinske perspektiv og det rent medicinske problem med at udelukke sygdomme ved patienter som almenhed – og ekstrapolerer dette til den grønne patient / AP patienten
Et paradigmeskifte er nødvendig indenfor lægevidenskab: At tolerere usikkerhed og mestre gråzonerne, samt at kommunikere dette til patienterne. Ændringer er nødvendige indenfor vores uddannelse, jura, fejlkultur, forskning og i sundhedssystemet som helhed. Ændres det ikke, vil det resultere i acceleration af det vi allerede ser: overbelastning af systemet, overdiagnosticering og ineffektivitet
Som altid, inden vi begynder, vil jeg henlede opmærksomhed på den fantastiske (og ofte) gratis litteratur som findes på nettet angående emnet
- Braithwaite, 2018: Changing how we think about healthcare improvement og http://www.stemlynsblog.org/only-a-game-infinite-game-theory-in-emergency-medicine/
- Carley et al, 2017 (St Emlyns, gratis e-bog): Risk, probability and decisions in emergency medicine (http://www.stemlynsblog.org/risk-probability-decisions-emergency-medicine-st-emlyns/) kapitel 1-7
- Goldman, Brian: Doctors make mistakes. Can we talk about that (https://www.youtube.com/watch?v=iUbfRzxNy20 )
- EMCC (emergeny medicine core competences) course manual
Although physicians are rationally aware when uncertainty exists, the culture of medicine evinces a deep-rooted unwillingness to acknowledge and embrace it. Embodied in our teaching, our case-based learning curricula, and our research is the notion that we must unify a constellation of signs, symptoms, and test results into a solution
[…]We believe that a shift toward the acknowledgment and acceptance of uncertainty is essential — for us as physicians, for our patients, and for our health care system as a whole. Only if such a revolution occurs will we thrive in the coming medical era.
[…]
We believe that cultivating a tolerance of uncertainty, and addressing the barriers to this goal for physicians, patients, and the health care system, will require a revolutionary change in medicine’s cultural attitude and approach to uncertainty
[…]Educators can start by asking questions that focus on “how” and “why,” not “what” — stimulating discussion that embraces the gray-scale aspects of human health and illness, aspects that cannot be neatly categorized, and encouraging students’ curiosity to explore and capacity to sit comfortably with uncertainty
[…]As we move further into the 21st century, it seems clear that technology will perform the routine tasks of medicine for which algorithms can be developed. Our value as physicians will lie in the gray-scale space, where we will have to support patients who are living with uncertainty
Arabella L. Simpkin et al, 2016: Tolerating Uncertainty – The Next Medical Revolution
How low can you go?
Limbo cool, limbo fine
David Hasselhof, The Limbo Dance
Everybody gets a chance
Clap your hands it’s party time
Do the limbo dance
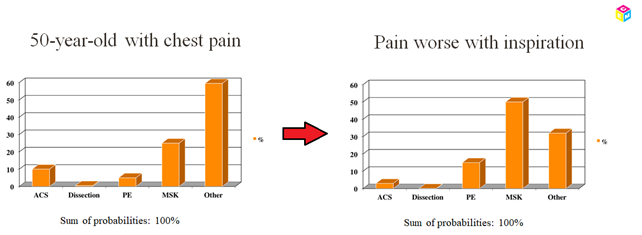
Når summen af alle diagnoser for en præsentation (fx brystsmerter) er 1, vil enhver test der udføres få det “differential diagnostiske landskab” (din liste over dine sandsynlige og farlige differentialdiagnoser) ændre sig ift sandsynlighed for de enkelte sygdomme.
Spørger vi fx vores 50 årige brystsmerte patient om hans smerte forværres ved inspiration (diagnostisk test) og han svarer ja (diagnostisk test positiv), vil sandsynligheden for AKS falde (LR+ 0,35-0,65 for AKS – theNNT.com), og tilsvarende for øvrige differentialdiagnoser stige (til dels alene fordi ACS sandsynligheden falder og summen af alle diagnoser = 1. Til dels fordi nogle af de andre diagnoser er mere associerede med pleuritisk chest pain).
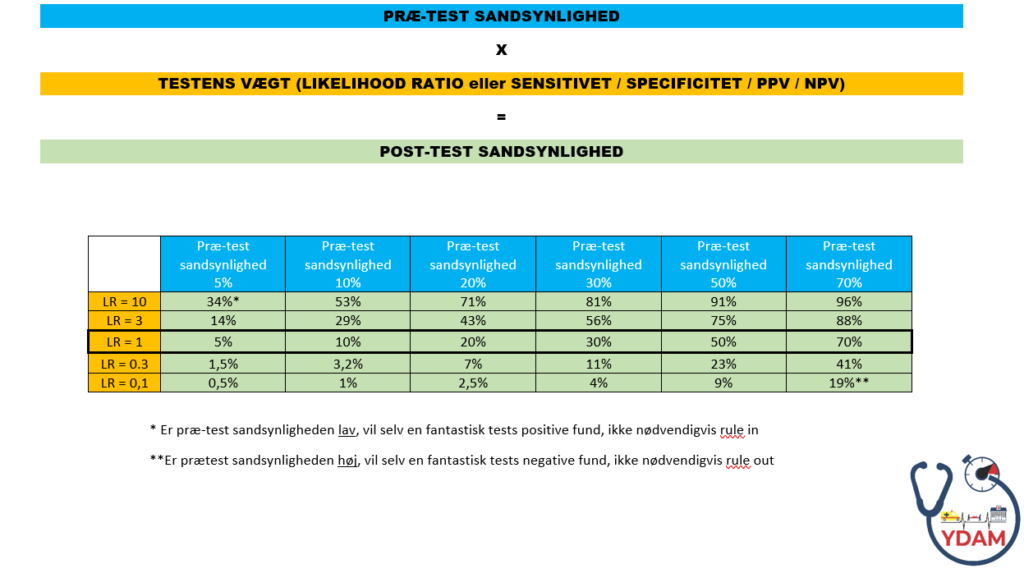
Tærskler for diagnostisk test og behandling afhænger af forskellige faktorer herunder STEPS. Men hvor langt, det er realistisk at komme ned, afhænger af præ-test sandsynligheden, og testens effektivitet (Sensitivitet, Specificitet og derfor LR). Lad os tage nogle eksempler, der evidensmæssigt er ganske velfunderede:
Din 50 årige patient har ikke-typiske brystsmerter, ingen forandringer på EKG’et, ingen risikofaktorer og første troponin er normal
Hvad er hans risiko? Hvilken risiko vil du turde sende ham hjem med for at misse et AKS? Eller LE? Aortadissektion? Hvilken risiko vil du acceptere, hvis du var patient? Hvilken risiko accepterer du som læge (juridisk og professionelt)?
Lad os prøve at tage det et skridt ad gangen:
Lad os sige, at din gestalt (De 3 G’er, som Casey Parker kalder det: gutfeeling, guesswork and gestalt), siger dig, at patienten IKKE har AKS, eller du er næsten helt sikker på, at det ikke er AKS ud fra historien og basale undersøgelser – hvor lav er patientens risiko så for AKS?
Et vellavet svensk studie fra akutmodtagelsen om netop dette spørgsmål (Mohktari og Dryver et al, 2015), kan fortælle dig, at ved hhv “ingen mistanke” eller “lav mistanke” om AKS, er LR 0,01 (0,00-0,12) og 0,4 (0,3-0,6) for at misse en patient, der alligevel har AKS indenfor de næste 30 dage. Før du overhoved ved noget om din brystsmertepatient viser epidemiologiske studier en præ-test sandsynlighed på ca 10% for AKS (altså 10% af patienter i akutmodtagelsen med brystsmerter har AKS) – af denne grund optriageres denne præsentation ofte. Anvendes din gestalt med blodprøver og anmanese alene (jf tabellen herover og fagan normogrammet herunder), vil du kunne reducere patientens risiko for AKS til hhv <0,01% (ved ingen mistanke) og ca 3-5% risiko (ved lav mistanke). Dvs vi har en teoretisk missrate ved denne patient på 1:10000 hvis vi ikke har mistanke, og 1:20-1:33 ved lav mistanke…hmmm….

Stoler du ikke helt på dig selv og din gestalt (Lawton et al, 2018)? Du har måske ikke set nok AKS patienter? Eller for nyligt set den der brystsmertepatient, som du troede ikke var noget, og som havde STEMI? Er din patient måske en ældre med en ”atypisk” præsentation?
Så findes der heldigvis hjælpemidler (Clinical decision rules – CDR) i form af HEART-scoren. Hvis altså din patient lever op til alle kriterierne for inklusion (>21 år, ingen nytilkomne EKG forandringer, ingen andre indlæggelseskrævende sygdomme, ingen hypotension og life-expectancy >1år), så kan du anvende scoren. Denne patient (og egentlig også dine patienter med risikofaktorer: http://www.stemlynsblog.org/risk-factors-factor-ed-st-emlyns-smacc-gold/ ) scorer 0-3 point ifølge HEART scoren, og får derfor kun en risiko på 0,9-1,7 % for AMI, CABG, PCI eller død indenfor 30 dage. Bedre!…ish. Medmindre vi selvfølgelig ikke havde nogen mistanke overhoved.
Men kunne patienten med brystsmerter ikke fejle andet?
Lungeemboli måske? Tager vi den bedste score for LE (Wells), får du 1,7% miss rate på 3 måneder. I Wells er der indbygget en slags gestalt (“summen af alle diagnoser = 1”, i spørgsmålet “PE is #1 diagnosis OR equally likely”). Går du udenom guidelines og alligevel laver en D-dimer (hey, der skal jo være flow – tjek lige LITFL ud angående den her vigtige og dejlige test: https://litfl.com/dealing-with-d-dimer-debacles/ ) eller en PERC score ovenpå 0 point Wells score, får du hhv 0,5% miss rate (d-dimer), og <2% miss rate med PERC. Er wells scoren positiv fanges en LE i 1/5 tilfælde med en CT angiografi. Hvor mange af disse, der er signifikante spørger du? Og virker behandlingen så også? Kan den skade? og hvor ofte? Hvor mange som har LE (sand positiv) kunne egentlig have været foruden behandling? Hvor mange kunne vi alligevel have sendt hjem uden problemer? (jf den simple og geniale streg-figur herunder fra St Emlyns herunder)
Stop lige engang hér
Ja hér!
Sluk TV’et og dine andre tabs kan være på stand-by – sluk for børnene og kæresten..bare lige 1 minut…det er vigtigt det hér: Studer den hér figur i bare 1 minut, og tænk igennem den seneste patient du så. Hvordan stillede du diagnosen? Hvad er risikoen for Falske negativ Vs Falsk positiv? Hvad har patienten at vinde ved behandlingen – hvad har de at tabe? Er det vigtigt for dem? Måske vigtigere end det, de har at vinde?

Fra Carley et al, 2017 (St Emlyns, gratis e-bog): Risk, probability and decisions in emergency medicine, kapitel 5 eller http://www.stemlynsblog.org/emergency-medicine-a-risky-business-part-5/
TAK – du har gjort dig selv og dine patienter en god gerning!
Det tog mig et tid at forstå vigtigheden af denne stregfigur. For ikke, at bloggen bliver for lang, vil jeg ikke dvæle længere ved den, og i stedet STÆRKT anbefale at læse kapitel 4 og kapitel 5 i Risk, probability and decisions in emergency medicine (St emlyns – link herover), der udmærket svarer på disse spørgsmål.
Nu vel….Aortadissektion! har en 0,1% præ-test sandsynlighed i akutmodtagelsen ved patienter med brystsmerte (1/1000 har aortadissektion i internationale studier). ADD-RS, fortæller os, at med en score på ≤1, har d-dimer en LR- på 0,02-0,07. Dvs betydeligt <0,1% post-test sandsynlighed. Scoren er dog ikke fuldt eksternt valideret med d-dimer, og det er usikkert, hvor god den er i lav-sandsynlighedsgrupper, som vores case.
Så CDR’s (clinical decision rules) er ikke altid entydigt bedre end vores gut-feeling (som vi i øvrigt fra start også har anvendt for overhoved at tænke, at patienten havde ”brystsmerter”, og ikke ”rygsmerter” eller ”åndenød” som præsentation). Vi skal nok ikke kaste vores gut-feeling helt væk endnu.
Hvor ofte kan du leve med at misse en AMI?
Dette har Professor Rick Body fra Manchester et godt svar på. Det hurtige svar, er at når man spurgte læger i et studie, så ville 4/10 acceptere en miss-rate på 1% for MACE (major adverse cardiovascular events). Jeg vil lade det hænge i luften og overlade det til Justin Morgenstern fra first10Em’s gennemgang af outcome, at afgøre, om MACE er et godt mål for cardiac outcome.
Men hvor ofte sender vi rent faktisk en patient hjem, der sidenhen kommer ind med et AMI? Dette har Justin Morgenstern også kigget på i sin blogserie om stresstests, der er højst anbefalet læsning!
Alt det her er blot en gennemgang for én sygdom (AKS) for én præsentation (Brystsmerter). Ofte er patienter ældre, præsenterer atypisk, multisyge og det er uklart, hvad patienten egentlig har af præsentationssymptom (såkaldt Non-specific complaint – som har en af de højeste mortalitets-rater af alle akutmedicinske præsentationer). Ovenpå det, så er det hér nok ikke den eneste brystsmertepatient du ser i dag – eller denne time!
Dr. Cox, I want to thank you for that “everyone’s a murderer” speech. Nice scare tactic. Unfortunately, my residents have stopped eating
J.D fra Scrubs, Sæson 4, episode 4 (my first kill)
Alt det her kan hurtigt påvirke os som klinikere, og kaste os ind i en slags paranoia over at misse noget. Når patienterne ovenpå det, er bange, og hyppigere og hyppigere kommer til akutmodtagelsen for mindre besvær (jf del 1 i denne blogserie), ender det ofte med, at de stiller de gyldne spørgsmål: ”jamen, hvordan kan du være sikker!?” eller ”kan du ikke spørge en senior læge”, eller ”kan jeg ikke bare få [indsæt undersøgelse eller behandling som de har en (oftest falsk) forestilling om er helbredende]”
Dette bringer mig til en anden del af problemet: jura, politik og beslutningstagning efter fejl hændelser
Hvems risiko er det egentlig, vi forsøger at sænke?
Svendborgsagen er ikke unik i litteraturen, og den kommer (desværre) ikke til at være den sidste heller. Forventningerne på os som læger, er, at vi skal være perfekte, trods et ringere og ringere arbejdsmiljø, højere arbejdspres, flere patienter sendes til akutmodtagelserne (Men formentligt ikke flere syge patienter) for en sikkerheds skyld og større forventningspres fra befolkningen om ventetider, behandlingsgarantier og undersøgelser (sjældent med evidensgrundlag og oftest uden en realistisk forklaring- og forventningsafstemning fra offentligheden / politikerne til befolkningen). Ovenpå alt dette, er der den evige ”usikkerhed”, som aldrig vil kunne undslippes når vi taler om sandsynligheder (probabilistisk medicin):
Det virker til, at hver gang der opstår en ”probabilistisk fejl” (af mangel på bedre ord, hvor vores patietneksempel sendes hjem og alligevel indenfor en kort tidsperiode får AKS / LE / aortadissektion) efter lægelig vurdering, bliver løsningerne ofte for aggressive. Nye vejledninger, x5 ekstra skemaer skal udføres – befolkningen er rasende og BT og Ekstrabladet er med fra start (overdrivelse fremmer forståelse). Alt sammen med et netto resultat, der øger den administrative byrde, sænker befolkningens tiltro til os og øger deres egen usikkerhed/utryghed i systemet endnu mere.
Altså en ond cirkel (dermed ikke sagt, at der ikke skal efterforskes når problemer opstår, for at udbedre evt fejl – det skal blot være afstemt). Forestiller man sig 1813 eller 1177 (som det hedder i Stockholm) som en ”test” med en sensitivitet / specificitet, vil mantraen “vi vil ikke misse NOGEN”, resultere i “blødere” visitationskrav og dermed gøre, at sensitiviteten teoretisk stiger, på bekostning af specificitet. Altså vil mængden at patienter, der sendes ind være større, og med færre syge i puljen.

Løsningerne på disse hændelser som svendborgssagen og andre tragiske patient-cases, uanset hvor vigtige de måtte være, vil desuden ofte presses ned over hovedet på klinikere (såkaldt top-down), i stedet for at spørge klinikerne om årsagen til hændelsen.
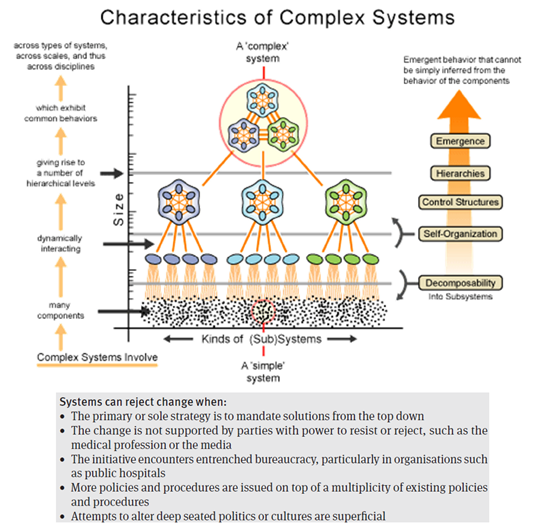
Uden en større forelæsning om dette store problem, kan vi blot sige, at løsninger skal til stor del komme NEDEFRA (botton up) og ikke blot OPPEFRA (top down): via dialog mellem ledelsen, og folk på gulvet. Sker dette ikke, vil det ofte føre til unødigt øget kompleksitet og manglende effekt (jf Braithwaite 2018 og https://necsi.edu/visualizing-complex-systems-science ) – et eksempel på dette er i min subjektive mening, implementeringen af SP (Sundhedsplatformen) i København. Jeg oplevede det førstehånds, da jeg arbejde på det første hospital, der fik SP. Folk gjorde (gør) oprør; Det skabte øget bureaukrati (afdelinger er stad; folk komformiterer ikke fordi det var (er) håbløst at arbejde med og “toppen” har ikke forstået “bundens” problemer (som kunne være så simple, som at få TnI i AKS pakkerne), og afskriver det som manglende omstillingsparathed. Dette er ikke en hade-kampagne imod SP. Snarere et system design, der 1) tillader det at ske, 2) ikke har feedback mekanismer til at løse kritiske problemer hurtigt. At fjerne SP igen, er IGEN en top-down problemstilling, og vil formentlig ikke erstattes af noget bedre:
Problemet ligger i designet af den måde, der træffes (top down) beslutninger på i vores sundhedssystem – og sundhedssystemer i al almindelighed
En simpel løsning
Den logiske konsekvens af alt det er, er jo, at vi undersøger alle; altid; for alt, for at sænke sandsynligheden mest muligt. Det er dog hverken muligt (prøv at bestille en CT angio og KAG på alle dine patienter med brystsmerter, og se hvor hurtigt du får opkald fra radiologen om kapacitetsproblemer) eller ønskværdigt bl.a. pga stråleskade risiko, risiko for sygeliggørelse (incidentalomer m.m), risiko bivirkninger / komplikationer, overbelastning af systemet, dårlig spendering af ressourcer, lange ventetider m.v.
Men er balancen sådan, at vi som læger pga urealistisk forventningspres og risiko for juridisk forfølgelse fra befolkningen, fra politikerne og fra os selv (second victim syndrome – https://www.emra.org/books/emra-wellness-guide/ch-8.-second-victim-syndrome/ og ACEP s 86 https://www.acep.org/globalassets/sites/acep/media/wellness/acepwellnessguide.pdf ) ikke tør stole på vores kliniske skøn, vil vi hellere være ”på den sikre side” end ikke, og bestille ekstra undersøgelser (selvom der egentlig ikke er klinisk belæg for det).
The […] risks of overdiagnosis are, rarely if ever, linked by patient or clinician. If I decide to CT all children with head injuries from this day forth I will no doubt cause many cancers and cataracts in my patients. However, these complications will take place many years in the future. I will never see them and it’s highly unlikely that the patient will ever associate an unwarranted investigation with a future disease
Simon Carley, Professor i Akutmedicin, Manchester, St emlyns: Risk, probability and decisions in emergency medicine, 2017 (e-bog)
Konceptet kalder Simon Carley for Risk Proximity (kapitel 7: Risk, probability and decisions in emergency medicine ). Den ultimative konsekvens af dette er, at risikoen vi prøver at reducere, i mindre grad bliver patientens risiko for sygdom, og i højere grad vores egen risiko for at misse noget. Sagt på en anden måde; vi kan anklages for at misse en LE indenfor de næste 30 dage, men sandsynligheden for at vi anklages for
- Patientens cancerdiagnose om 30 år pga stråling
- Den ressource byrde det er på systemet at bestille ekstra undersøgelser
- Den manglende CT tid, til patienten i seng 6, der virkelig behøvede den, og døde som konsekvens af forsinket diagnostik (igen, overdrivelse fremmer forståelse)
- Den overdiagnosticering og sygeliggørelse af patienten (incidentalomer og flere undersøgelser, undgåelse af diagnosticering af funktionel sygdom som har behov for anden slags behandling)
- De evt bivirkninger, der er ved behandling af reel- og ikke reel sygdom fundet ved overdiagnosticering
Er meget lav! Sætter vi det på spidsen, har vi har altså ikke andet incitament end vores egen samvittighed og moral til at undlade ekstra undersøgelser. Dét er katastrofalt for patienten (selvom de lever i uvidenhed, og er ofte blot glade over ekstra undersøgelser)!
Jeg afslutter med endnu en Coxism
If you want to be good doctors and nurses, you damn-sure better get ready to get in trouble – a lot. Because patients are stupid, and they are really scared. And some of them need you to hold their hands, and you should. Others need you to kick their asses, and you absolutely should do that, too. But, it really all just comes down to whether or not you got the guts to say just exactly what you know in your heart of hearts you really should say.
Dr Cox, Scrubs: sæson 2, episode 21
Kære alle – lad os sammen arbejde imod, at vi kan få “the guts” tilbage!
Vi har alle (læger, sygeplejesker, politikere, patienter) et ansvar for at ændre balancen, så vi som sundhedspersonale kan få lov at “komme i problemer lidt mere”, FOR patienternes bedste – uden en ret balance tør vi ikke “komme i problemer” for patientens bedste, og vil fortsætte med overdiagnosticering / defensiv medicin, til skade for alle involveret
Løsningen: vi har brug for hinanden
Dette er et komplekst problem uden en simpel løsning. Løsningen er desuden på flere niveauer. Jeg er ikke ekspert på dette område, men fra mit synspunkt (i bunden af hierakiet) kan jeg umiddelbart sige at følgende er langsigtede og potentielt forbedrende løsninger
Lad mig høre, hvad I synes kan være en løsning?
Hvad kan vi gøre som læger i akutmodtagelsen?
1) Kulturændring: Gå væk fra absolutisme og dikotomi’er (ja/nej, udelukket eller ikke; forsøg på at sænke sandsynligheden med unødige undersøgelser udover hvad der er “relevant”), og bliv mere bekvem med “grey areas”. Forstå konceptet med at tolerere og kommunikere usikkerhed igennem hele systemet, og være med til at gøre det til en skill i lægevidenskab, og akutmedicin i særdeleshed:
- Afslutning af patienter fra akutmodtagelsen: patienter skal have ordentlig information når de skrives hjem – der er en grænse for, hvor meget vi kan udelukke, og ”sygdommens naturhistorie” vil afgøre om de kommer tilbage (regression to the mean). Man kan evt kategorisere patienter i ”høj” og ”lav” risiko og forklare dem i større eller mindre detalje, hvad de skal være opmærksom på (gerne med standardiserede skriftlig information, da de ellers glemmer detaljer)
- Show more spine (guidelines): https://www.cebm.net/2016/11/squidgy-guidelines-can/
- Shared decision making når muligt (skal afstemmes individet): dette er den ultimative løsning på problemet med risiko-reduktion (nogle individer er mere risk-prone end andre)
- Forventningsafstemning med patienterne (jf kommunikationsbloggen)
- Uddannelse i probabilistisk tankegang, decision making og kommunikation: start gerne med kilderne på blogindlægene på området
- Vi står sammen som læger om at udføre evidensbaseret medicin (EBM) så vidt muligt (og når vi af en eller anden grund ikke kan: forklarer patienterne, når vi laver en samvittighedsskanning eller udskriver antibiotika når der er spinkelt grundlag – så de ved, at det ikke er reglen. Desuden grundigt forklarer om konceptet ”incidentalomer” før undersøgelser)
- Vær empatiske mod kollegaer, særligt overfor patienterne. Det gavner INGEN at tale ned om andre læger
- Anvende os af konceptet “regression to the mean” (som i almen praksis) / ekspektans, når man ikke kan sænke sandsynligheden mere i akutmodtagelsen. Ud fra det øjebliksbillede vi ser patienten i, kan vi IKKE finde grundlag til videre diagnostik. Lad der gå nogle dage, og hvis ikke sygdomsbilledet bliver mere klart, så er sygdommen gået i sig selv
- Blive bedre til at kommuniker muligheden for diagnoser, der ikke kan stilles med blodprøver, billedediagnostik eller anden paraklinik hurtigere i forløbet (såkaldte “udelukkelsesdiagnoser”) såsom funktionelle tilstande – patienten lider i mellemtiden, og bliver kun sygere af flere undersøgelser. Aftal med patienten hvornår sandsynligheden er sænket “nok”, og lav realistisk forventningsafstemning om dette niveau. Tal ikke om den “psykosociale” komponent af en sygdom, som noget man KUN kan tale om når al somatik er udelukket. Den er LIGESÅ STOR en del af samtalen – ofte fra start – uanset årsag til symptomerne, og SAMEKSISTERER og påvirker den somatiske tilstand (bio-psyko-social modellen – BRUG DEN og kommuniker den til patienterne!). Negligerer vi den side, negligerer vi ofte størstedelen af sygdomsbilledet.
- Vær opmærksom på, at på trods af overstående forslag om probabilistisk kommunikation, skal nogle patienter have kommunikeret risiko på en mere simpel måde (nogle gange paternalistisk)
2) Flere studier i akutmedicin populationen: Udføre studier, der approximerer tests effektivitet (LR) og Inter-rater-reliability (IRR fx v k-værdier) og behandlings effektivitet (NNT) i de befolkninger vi arbejder med, på de hyppigste præsentationer og sygdomme (illness scripts) – såsom Mokthari og Dryver et al, 2015 (Jf også ben Goldacre: less focus on academic achievement in medicine and more effort to be made in disseminating practical data and advice to clinicians that can quickly improve patient outcome – https://www.youtube.com/watch?v=MJppm_h0a9Y )
3) Skabe et sundt miljø på afdeling, og i det hele sundhedssystem:
- Skabe et sundt (ikke toksisk) miljø for uddannelse, feedback, fejlkultur og håndtering af fejl (fx skal vi kunne tale om fejl åbent, uden risiko for at blive anklaget for det. På den måde vokser vi og bliver klogere. Dette gøres bedst nedefra og op – skab miljøet på jeres afdeling, hvor I fortæller, I har lavet en fejl. Det fungerer bedst, hvis en overlæge tør sige det – så er det lettere for yngre læger! Lav det gerne i form af en case-gennemgang: Gennemgå cases prospektivt og ikke retrospektivt – hvad ville de andre have gjort med denne patient? Hvorfor? (det sænker hierakiet og øger læring!)
- Optimere vores forhold for decision making (= arbejdsmiljø)
- Bliv del af bottom-up beslutninger: Skab fritid på arbejdspladsen for at medarbejdere kan FÅ LØN for at udvikle gode løsninger! (igen – arbejdsmiljø!)
Hvad kan lederne / politikerne gøre?
- Forstå, at patientSTYRET ikke er en god model for sundhed. Frit valg skaber utryghed. Lad sundhedsprofessionelle guide patienterne i shared decision making. Dette er pædagogik 101.
- Forventningsafstemning med befolkningen – hvilket slags sundhedssystem vil vi have? (vi kan ikke få det hele)
- Styrke primær sektoren / AP lægerne – forlad ikke konceptet med, at én patient har én læge som holder i dem. Det skaber unødig utryghed hos patienterne (tydelige tegn fra Stockholm)
- TAL MED OS om løsningerne. VI SKAL AREJDE SAMMEN!: Undgå top-down beslutninger uden folk på gulvet (bunden af hierakiet = læger og øvrigt sundhedspersonale, som arbejder med det til dagligt) er en betydelig del af beslutningen. Opfordr til bottom-up, og gør det muligt for afdelingerne at få tid til det (admin dage, og anerkendelse af de mange mængder timer, som læger arbejder gratis ved siden af jobbet) – Læs Braithwaites artikel herunder
- Forstå balancen mellem specificitet og sensitivitet (og at ingen test er perfekt)
- At ville have det hele for alle, hele tiden (24 timers mulighed for CT for alle), skader systemet pga overbelastning. Vi skal have en samtale om hvad der er realistisk og vigtigst.
- Forstå konceptet om ”probabilistisk fejl”, og at “udelukkelse” er et dikotomt- og potentielt skadeligt sprogbrug i sundhedssystemet, da det skaber urealistiske forventninger hos patienten. Først da kan vi have en sund og fælles diskussion om, hvor vi sætter grænser (i stedet for lappeløsninger, og top-down guidelines hver gang, der sker en ”fejl”) – skal AKS udelukkes 1/100 fejlrate? 1/1000? – hvilke ressourcer vil man afsætte til det? Er der nok bemanding til alle de undersøgelser?
- Forstå “risk proximity” for lægens synspunkt, og hvordan jura, der puster os i ryggen, blot giver mere overdiagnosticering og færre tilfredse patienter
- Forstå problemet med “low acuity patients” (LAP) i akutmodtagelserne
- Forstå hovedkoncepterne med Crowding: “Crowding is evil” (øger mortalitet, unødige indlæggelser, error-rate og forværrer alles oplevelse/arbejdsmiljø på akutmodtagelsen m.m.m), og er et systemproblem, der udfælder i akutmodtagelserne og kræver en hel-systemsløsning – særligt “exit block”-problemet. Er til dels pga:
- Input: flere ældre / komplekse patienter; øget volumen af LAP patienter; Ventetider hos almen praksis
- Throughput: Personale- og erfarings brist på akutmodtagelserne; test-resultat forsinkelse
- Output: Exit block
Hvordan ser det ud, spørger I? https://vimeo.com/120038976
Inspiration til løsninger? Tjek overstående kilder fra RCEM ud og denne video fra RCEM og “the ED hub”
Kilder
- Braithwaite, 2018: Changing how we think about healthcare improvement
- Carley et al, 2017 (St Emlyns): Risk, probability and decisions in emergency medicine
- Lawton et al, 2018: Are more experianced Clinicians better able to tolerate uncertainty and manage risk?
- Goldacre, Ben, 2009: Bad Science (regression to the mean)
- Blogs på akutmedicineren
- Probabilistisk tankegang
- Decision making
- Geriatric emergency medicine (GEM)
- Kommunikation
- Mokthari og Dryver et al, 2015: Diagnostic values of chest pain history, ECG, troponin and clinical gestalt in patients with chest pain and potential acute coronary syndrome assessed in the emergency department
- Simpkin et al, 2016: Tolerating uncertainty (https://www.nejm.org/doi/full/10.1056/NEJMp1606402 )
- CEBM: https://www.cebm.net/2016/11/squidgy-guidelines-cagn/
- https://www.preventingoverdiagnosis.net/