Andelen af ældre i akutmodtagelserne er stigende, og der kommer på intet tidspunkt i historien at være nok geriatere til at tage hånd om dem alle. Alle læger er geriatere i dag, og derfor er det vigtigt, at basale håndteringer af denne gruppe også udbredes indenfor akutmedicin (såkaldt GEM: Geriatric Emergency Medicine).
Professor i geriatri og co-editor of Geriatric Emergency Medicine (2018)
Simon Conroy – fra DASEM’s årsmøde april 2019 (paraphrasing)
…Geriatric Emergency Medicine is an ever more important specialist medical sector in every European country…Older people need special treatment, which does not always correspond to the general guidelines we normally use for other patients. This specialist care may encompass social, psychological, behavioural and end-of-life aspects of treatment. Illness presentations in older patients may be different and sometimes difficult
Roberta Petrino, president of EuSEM. Forord til Nickel og Conroy et al: Geriatric Emergency Medicine (2018)
Årtiets vigtigste bog, Factfullness (2018) af Hans Rosling, forklarer tydeligt, hvad vi allerede mærker i akutmodtagelserne: Accelerationen af befolkningsvæksten vil dale, efterhånden som verden udvikles fordi der simpelthen vil fødes færre børn i lande, med mulighed for karriere og sikkerhed i sundhed. Med øget velstand, kommer også øget life-expectancy. Vi ser derfor at alderspyramiderne bliver tykkere i toppen, og smallere i bunden.
For Danmark har Danmarks statistik lavet denne fantastiske graf, som man kan scrolle frem i tiden med og se hvordan toppen af alderspyramiden bliver bredere: http://extranet.dst.dk/pyramide/pyramide.htm#!y=2058
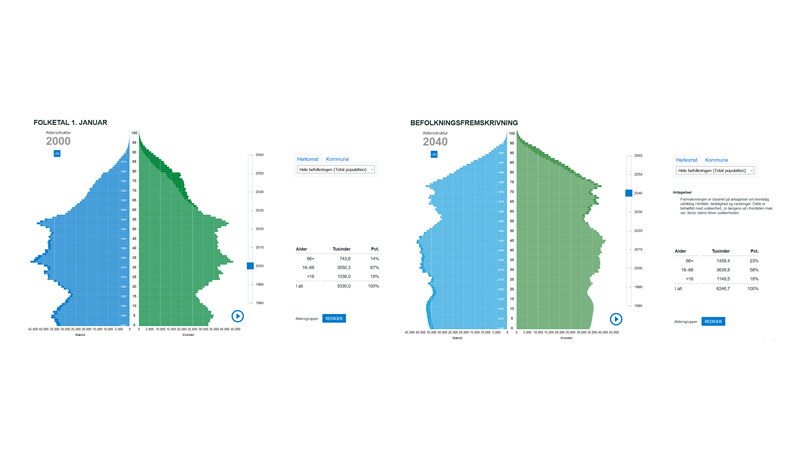
Fra 2000 til 2040 vil andelen af ældre >65 år være steget fra 14 til 23%. Forhåbentligt er de også raskere ældre (hvilket meget tyder på de (vi) vil være). Med højere alder, kommer dog også liv MED sygdomme og derfor øget kompleksitet. Selvom den øgede life expectancy også leder til flere kvalitetsår, vil Simon Conroys udtalelse om, at alle læger i fremtiden er geriatere, være slående sande. Indtil vi enten møder vores endeligt som art, bliver ubrugelige som læger (Max Tegmark: Life 3.0) eller finder kuren imod alderdom har alle læger i almenhed og akutmedicinere i særdeleshed behov for at have viden om geriatri – såkaldt GEM (Geriatric Emergency Medicine)
Derfor er dette blogindlæg en kort introduktion til basale begreber indenfor GEM, skrevet med en gæsteforfatter (en god ven, og dygtig læge) med bred erfaring indenforakutmedicin, såvel som geriatri: Kristoffer Brockhattingen.
Bloggen er i et andet format end de tidligere, og fokuserer på high-yield koncepter, man kan anvende direkte i sin hverdag i klinikken. For mere detaljerede beskrivelser af koncepterne findes i bunden, som altid, en detaljeret kildeliste til videre læsning.
Er du kliniker og skal læse én bog (+/- én artikel) på området, kan jeg særligt fremhæve
– den nye bog af Christian Nickels og Simon Conroy et al, 2018: Geriatric Emergency Medicine, samt
– Clegg, 2013: Frailty in elderly people
(https://www.ncbi.nlm.nih.gov/pubmed/23395245)
Tag gerne også Atul Gawandes “Being Mortal” med for en mere holistisk og narrativ fortælling
Er du en, der vil lidt mere: måske gøre akutmodtagelsernemere ældrevenlige; indeføre screening for delir, frailty og mobilitet (formentlig bedre mål end normale vitalparametre) eller blot søge inspiration fra, hvordan steder, der er kommet længst med ideen om GEM gør, kan jeg anbefale:
– ACEP’s Geriatric Emergency Department Guideline
– The silver book (NHS) og RCEMs guidelines
– Videnscenter for demens (fx om Delir og BPSD)
Et kort ord om affektivt bias
Vi har alle affektive biases, og for nogle af os, betyder det, at vi behandler ældre anderledes end andre aldersgrupper (nogle gange kaldet ”age-ism”). Der er intet unormalt i affektive bias – ingen er fri fra dem, og mange af vores bias er usynlige for os selv. Awareness og Feedback fra vores omgivelser er derfor essentielt for at opdage disse affektive bias blindspots. Det er kun et problem, hvis vi ikke bliver opmærksomme på det, og derfor ikke kan kompensere for det.
6 vigtige koncepter om ældre i akutmodtagelsen
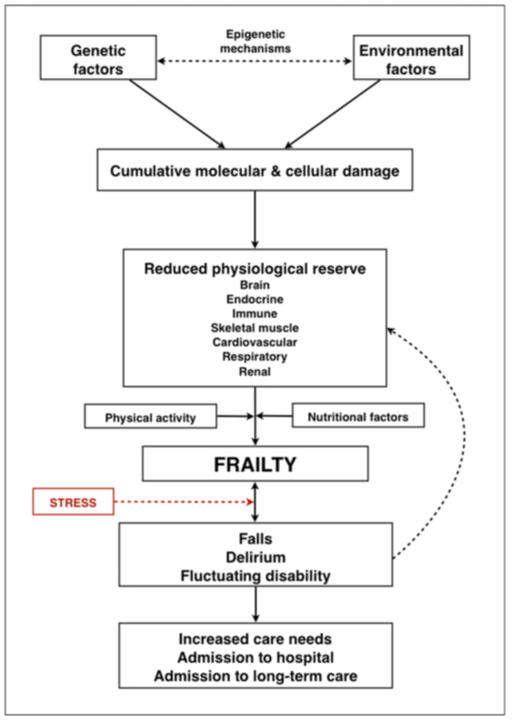
- Frailty (skrøbelighed / biologisk alder) : Selvom mortalitet- og morbiditet øges med alderen, er der generelt enighed om, at kronologisk alder, er et suboptimalt mål for mortalitet og morbiditet Selvom der findes forskellige definitioner for frail (Clegg et al, 2013, Nickel- og Conry et al, 2018). Derimod er patientens biologiske alder (frailty-grad) et bedre mål for prognose. Frailty udvikles efterhånden som patienten akkumulerer problemer fra forskellige dele af bio-psyko-social modellen (fx utilsigtet vægttab seneste år, nedsat styrke- og funktion, lav fysisk aktivitet, langsom ganghastighed – og findes ofte sammen med polyfarmaci og multisygdom, samt begyndende
kognitive deficit), og kan dermed også ramme folk <65 år, særligt i sårbare grupper (figur 1). Ældre med frailty, har betydeligt højere mortalitet og morbiditet, end ikke-fraile på samme alder, og har ikke samme cost-benefit af aggressiv behandling og diagnostik. 10% >65 år, og 25-50% >85 år er frail, og behandlingen bør i denne gruppe i højere grad rettes imod livskvalitetsøgende – i stedet for livsforlængende – behandling, optimalt efter samtale med patienten / pårørende om deres ønsker. Patienter, der begynder at kunne dekompensere, som tidligere har haft højt funktionsniveau (jf dekompensering herunder), kaldes ”pre-frail”, og kan måske have gavn af hurtig holistisk intervention for at vende vejen direkte imod regelret frailty (Clegg et al)
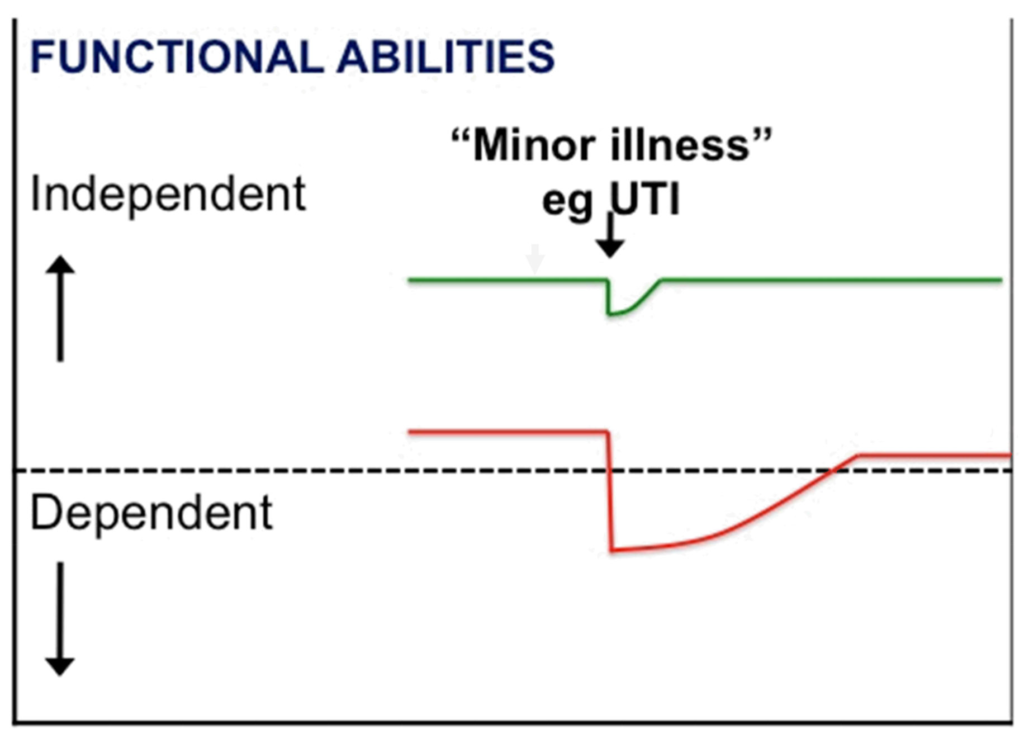
- Dekompensering og de geriatriske syndromer: En af de ting, der definerer gruppen af ældre med frailty (rød linje), er at de ikke er modstandsdygtige som unge (grøn linje). Udsættes en ung- og en frail ældre patient for samme stressor (fx UVI) vil der resultat være vidt forskelligt (figur 2):
- 1) Begge patienter taber i funktionsniveau, men den ældre fraile patient kan komme nær- eller under en grænse for selv-vedligeholdelse (fx spise, drikke, mobilisere sig, delir, “mekanisk” fald m.v) – dette kan man kalde en dekompensering. Er patienten tilstrækkelig frail, vil de med mindre og mindre stressorer (fx flytning, obstipation, søvnbesvær) ”dekompensere” og falde under linjen for selvstændig livsførsel.
- 2) Tabet i funktionsniveau er større ved en frail patient end ved den unge
- 3) Når en frail patient udsættes for en stressor, tager det længere tid at komme sig, og patienten vil ikke altid opnå samme niveau som før dekompenseringen.
- Konklusion: Patienter, der dekompenserer kommer ikke i akutmodtagelsen med ”dekompensering” stående i panden (eller som initial diagnosen fra triagen), men i stedet enten som ”fald”, ”delir”, uholdbar hjemmesituation, uspecifik klage (NSC), causa socialis m.v. Ved disse præsentationer (fx fald eller delir) skal man derfor ”gå efter bolden, og ikke manden”, og tænke på underliggende årsag. Ældre skal IKKE falde, og bliver IKKE delirøse uden årsag, og bør betragtes som akutte tilstande ligesåvel som alt andet tidskritisk vi ser i akutmodtagelsen, indtil modsatte er bevist, da der er betydelig potentiel reversible mortalitet- og morbiditet forbundet med delir- og fald. Årsager kan være banale – afhængigt af graden af frailty (fx UVI eller nylig flytning) – men kan også med samme præsentation sjældnere være seriøst (AKS). Foruden fald og delir, er de øvrige hyppigt nævnte dekompenseringspræsentationer / geriatriske syndromer inkontinens, tryksår, søvnforstyrrelser og immobilisering (samt polyfarmaci)
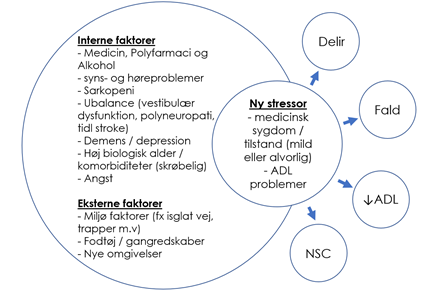
- NSC (Non-Specific Complaints): Ældre som helhed, og fraile patienter i særdeleshed, vil ofte præsentere med symptomer, som ikke umiddelbart kan puttes ind i vores ”symptom-kasser” fra triagen (fx ”svaghed”, ”træthed”, ”uholdbar hjemmesituation” eller ”mindre problem”). Disse patienter har højere mortalitet end nogen anden gruppe i akutmodtagelsen.
Mantraen er: Atypiske præsentationer på alvorlig sygdom, er typiske ved ældre, særlig frailr ældre (fx AKS præsenterer med synkope eller dyspnø; pneumoni kan være alene med øget RF og uden hoste m.v). Ud fra europæiske studier (Nickel et al), er de hyppigste årsager: infektion, dehydrering- og elektrolytforstyrrelser, hjertesvigt, anæmi, udiagnosticerede kognitive deficit
- Svageste organ ryger først: Det har længe været kendt blandt geriatere, at patientens svageste organ er det, der sætter ud først, når kroppen bliver stresset / dekompenserer. For mange ældre, er dette hjerne, nyre, hjerte eller lunger, og derfor vil patienter med kendt sygdom i disse organer være i risiko for forværring i funktionen af disse organer under akut stresspåvirkning. Et eksempel, som jeg selv ofte ser, er patienten med tidligere neurologisk sygdom (særlig stroke), som kommer ind med forværring af tidligere rehabiliterede symptomer pga metabolisk stressor – såkaldt ”post-stroke recrudescence” (PSR) . Et andet eksempel er ved demente med “svag hjerne”, som kan udvikle BPSD (jf herunder).
- BPSD (behavioral psychiatric symptoms in dementia) og Oligofrene (“unge med skrøbelige hjerner” overfor stressorer): En slags dekompensering ved ældre med demens. Demente patienter har hjerner, der er ekstra skrøbelige for stressorer, og derfor vil dette ofte være første organ der bliver dysfungerende (”svageste organ ryger først”) ved udsættelse for stressorer (obstipation, smerte, medicinændring, polyfarmaci, ændring i omgivelser, søvnbesvær m.v) og give en præsentation med adfærdsændring og/eller delir. Dette gælder i øvrigt også oligofrene / mentalt retarderede, der ikke sjældent præsenterer med at være ”anderledes”. Ved adfærdsændringer i patienter med demens- eller oligofreni, skal man håndtere dem på samme måde som ved delir angående årsagsanalyse (jf herunder), og være opmærksom på, at indlæggelser i uvante- og urolige omgivelser (fx FAM, medicinske afdelinger m.m), potentielt er forværrende for deres tilstand (der ikke nødvendigvis er livstruende men kan være milde ting som obstipation, smerte, medicinændring, ændring i omgivelser m.v). Optimalt har man derfor familiære elementer med under indlæggelsen (billeder, kontaktpersoner, familiemedlemmer m.m), for at lindre angst/stress og tilstanden. Desuden bør man anvende de 4 råd fra videnscenter for demens
- Sarcopeni / Muscle wasting: En stor del af ældre patienter har sarkopeni. Den europæiske definition af sarkopeni blev opdateret i 2018 og dækker over faktorerne muskelstyrke herunder muskelmængde(kvantitet) og muskelkvalitet der udtrykkes i dårlig perfomance(nedsat motoriskfunktion herunder gang, stand og siddestilling). Patienter med udtalt sarkopeni har en væsentlig dårligere prognose i forbindelse med indlæggelser og kortere forventet restlevetid samt nedsat quality of life (jf i øvrigt appendix 1)
6 tips til undersøgelse af den ældre i akutmodtagelsen
- Vitalparametre og triagering: Ældre patienter har tendens til undertriage i flere af triage-systemerne (NEWS, DEPT m.v) til dels pga vitalparametrene taber sensitivitet- og specificitet for alvorlig sygdom ved ældre, og til dels fordi ældre præsenterer med atypiske symptomer på alvorlig sygdom (jf herover). Derfor anbefales, at man ved triage af ældre: 1) ikke i høj grad afhænger af vitalparametre (jf herunder) – RF er den sikrere 2) Fokuserer på den akutte kliniske situation- og præsentation (gestalt), snarere end detaljeret medicin- og tidligere sygdomshistorik (Nickel et al) for at bedømme risiko, 3) Medregner frailty, polyfarmaci og tab af funktion i fortolkningen, 4) Systematisk leder efter “dekompenserings syndromer”, som delir (evt ved CAM-scoring i triagen), 5) Fokuser på gang/mobilitet- og hastighed som “vitalparametre” (tjek fx Professor Mikkel Brabrands studier på området) (, 6) Integrering af proxyanamnese fra pårørende i triage-processen, 7) Informer om processen i triage- og akutmodtagelsen, 8)
- TP: 1/3 har ikke feber ved sepsis. Således er TP mindre sensitiv for infektion ved ældre (man kan have infektion uden feber). Har ældre derimod feber >39 (særligt kombineret med RF >30 og HR >100-120), er der ofte tale om alvorlig infektion
- RF: Respirationsfrekvens er formentlig mest sensitive vitalparameter for alvorlig sygdom hos ældre – særligt, da denne sjældnere er påvirket af polyfarmaci
- BT: Fokuser mere på den relative blodtryksændring ift det normale blodtryk, i stedet for den absolutte. Ved hypertoni patienten som normalt ligger 160/90, kan 120/90 være hypotension, og omvendt ved den lille ældre sarkopene dame, kan 80/50 være et normalt blodtryk. Følg evt udviklingen af blodtrykket på akutmodtagelsen, hvis man ikke har tidligere af jævnføre med
- Puls: mange ældre anvender puls-regulerende midler fx betablokkere
- Abnorme (klassiske) vitalparametre: Generelt er vitalparametrene påvirkede af polyfarmaci (Tp: alvedon, BT/P: blodtryks- og antiarytmika m.m, og et nedsat fysiologisk respons på stress hos den ældre. Hvis den ældre har abnorme vitalparametre, bør dette vægtes højere end ved den unge

- Frailty score (CFS) : Vinder mere og mere belæg for dens anvendelse i akutmodtagelsen og er bedre end mange andre værktøjer til at vurdere ADL (activities of daily living), præ-morbid status og fremtidig prognose. I England anvendes aktuelt Rockwoods clinical frailty score (herover), til at vurdere graden af frailty. Af ovenfor nævnte grunde kan dette være vigtigt for valg af tiltag og aggressivitet af behandling. Frailty scoren må aldrig være eneste del af vurderingen af behandlingsbegrænsning.
- Delir scores: Delir er ”hjernesvigt”, er derfor en tidskritisk tilstand på linje med andre organsvigt (både pga delir i sig selv er skadeligt, men også fordi det ofte repræsenterer behandlingskrævende underliggende sygdom). 10-20% >65 år i akutmodtagelser har delir, men op imod 50-75% diagnosticeres ikke rettidigt – dette særligt ved hypo-aktivt delir. Opdages det ikke fra start i forløbet, kan man pga bl.a. framing-bias få forsinkning af diagnostikken. Af alle disse grunde, er systematisk screening af ældre >65 år for delir et værktøj, der bør overvejes at implementeres i akutmodtagelserne (og muligvis bedre end vitalparametre jf herover). Forskellige scores er studeret i akutmodtagelserne – de fleste af disse har sensitivitet >85-90%, men variabel specificitet. Dvs er de negative, er delir oftest udelukket. Udvalgte bedste, og mest anvende scores er (data fra Nickel et al) – SQiD er eneste, der ikke kræver træning:
- SQiD – Single Question in Delirium (sensitivitet: 91,4, specificitet 61,3%, LR+ 2,37 , LR- 0,14): Simpel test, der ikke kræver øvelse. Man spørger patientens nærtstående, om patienten har været mere forvirret seneste tid. Er svaret ja, er testen positiv
- CAM – Confusion Assesment Method (Sensitivtet 94%, specificiet 89%, LR+ 8,55 , LR- 0,07): CAM eller CAM afarter anvendes typsik i Danmark. Anbefales via SST.
- bCAM – brief CAM (sensitivitet: 70-84%, specificitet: 91-97%, LR+ 7,78-28 , LR- 0,16-0,33). Findes i varianter med CAM-ICU
- DTS – Delirium Triage Screen (sensitivitet: 98%, specificitet: 55%, LR+ 2,18, LR- 0,04)
- Walk’n’talk / mobilisering: Akut tab af gangfunktion og mobiliseringsevne (fx fra båren til sengen), er det 6. vitalparameter, og formentlig en bedre indikator for mortalitet/morbiditet end mange andre vitalparametre ved ældre. Gå en tur med de ældre på afdelingen, og tal til dem imens du går med dem. Forværres gangfunktionen når de skal koncentrere sig om en samtale (provokeres), har de formentlig ikke meget at stå imod med.
- Fødder: Hvis patientens fodstatus er dårlig, kan de ikke nå deres tæer. Dette er et indirekte mål for mobilitet, og siger noget om ADL (kan anvendes hvis man ikke på nuværende tidspunkt kan få dem op og stå)
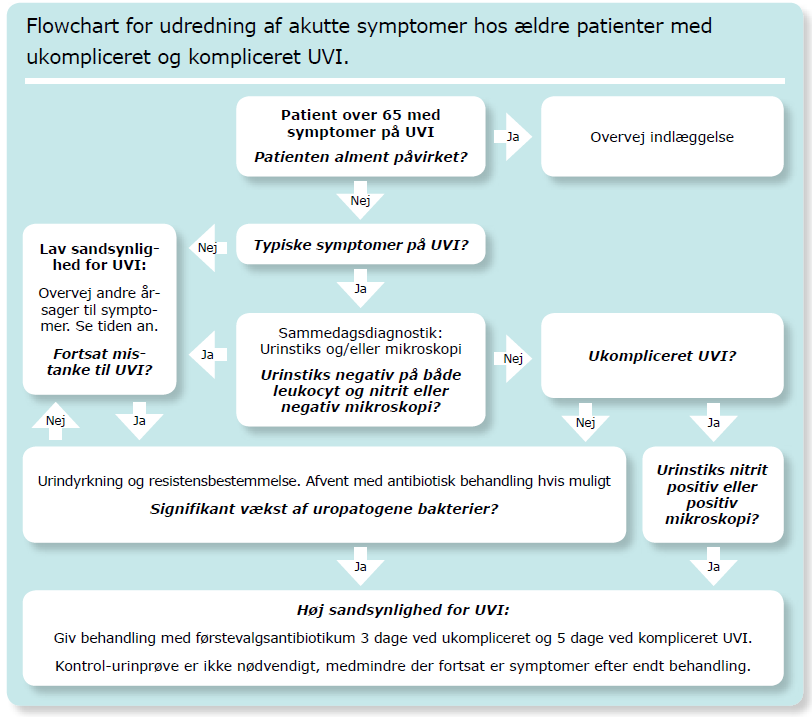
- ASB (Asymptomatic Bacteuria): 5% af baggrundsbefolkningen uden symptomer har falsk positiv dyrkningsresultater på urin-dyrkning. Dette kaldes asymptomatisk bakteriuri (ASB), og har ikke gavn af behandling (evidensbaseret i flertal af studier) – jf
IRF (institut for rationel farmakoterapi) har lavet fantastiske opsummeringer af emnet i 2011, og 2016 . Andelen med ASB stiger til 5-15 % ved ældre >60 år udenfor institutioner, og op til 50% hos ældre på institutioner (fx plejehjem). Alle med KAD har ASB. Hos en ældre patient med dekompensering (fx delir eller fald), er en asymptomatisk urinstix / dyrkningspositive fund, muligt ASB, og man skal altid lede videre for anden årsag (både andet infektionsfokus og andre årsager i det hele taget), og nøje overveje om behandling er nødvendig. Spørgsmålet om en delir-patient er asymptomatisk i UVI-terminologi er der ikke konsensus om. Behandling af delir patienten uden feber med urinstix eller dyrkningsfund er derfor en gang til gang vurdering – sjældent behøver man opstarte behandling før dyrkningssvar og anden udredning/behandling er foretaget (fx 24-48 timer efter). Alment om urinstix (data fra Nickels et al):- Leukocytter (-) OG nitrit (-) = NPV 98% (negativ urinstix udelukker UVI med stor sandsynlighed – særligt ved lav prætest sandsynlighed som asymptomatisk patient)
- Leukocytter (+) ELLER nitrit (+) = sensitivitet 94%, dårlig specificitet
- Leukocytter (+) OG nitrit (+) = specificitet nær 100%
5 underliggende årsager som altid skal overvejes ved ”dekompenseringssyndrom” (delir, fald, NSC)
- Infektion (særligt pneumoni og UVI, men også sepsis m.v): kan være svær at finde af grunde illustreret herover, og tærsklen for dyrkning ved NSC præsentation skal være lav.
- Polyfarmaci: >5-10 præparater. 30% af årsager til besøg på akutmodtagelser fra ældre >65 år. Som tommelfingerregel overvejes pausering / seponering / udtrapning af al medicin, som ikke er livsnødvendig. Husk altid ”start low, go slow”, når man ordinerer (og udtrapper) medicin for at undgå bivirkninger / abstinens.
- Hvilke lægemidler skal jeg pausere / seponere? – Anvend IRF / SST’s seponeringsliste, eller lignende. IRF og
DSAM har guides til medicingennemgang - Hvilke midler interagere med det jeg ordinere? Interaktionsdatabasen.dk, medstopper.com eller janusinfo.se
- Hvilke midler er særligt delir-fremkaldende? – IRF’s antikolinerg belastningsliste
- Hvilke lægemidler skal jeg pausere ved AKI (Acute Kidney Injury – tidl uræmi)? promedicin, dansk nefrologisk selskabs holdningspapir, KDIGO og den engelske Thinkkidneys side. Det korte svar: Undgå / neddoser følgende
- Lægemidler, der opkoncentreres ved særligt eGFR (fx NOAK, metformin, megen morfika, antibiotika-, antiviral- og antimukotisk medicin, thiazid og loopdiuretika, digoxin, lithium)
- Lægmidler, der er nefrotoxiske (fx >1 dose af gentamycin, ACE-hæmmere, ARB-hæmmere, NSAID) – særligt ACE-hæmmer/NSAID kombinationen!
- Kaliumbesparende midler (Kalium-tilskud, kalium-besparende diuretika- og antihypertensiva)
- Kontrast middel? Faren er formentlig stærkt overvurderet (St emlyns: artikel nr 8)
- Hvis nogensinde cisplatin behandlet? Undgå gentamycin for evigt
- Hvilke lægemidler skal jeg pausere ved langt QTc?
- Udredgning af QTc – det lange svar (afhænger af hvilken formel man anvender og hjertefrekvens) og det korte svar (anvendes, hvis man har >440-500 i QTc for at efterregne maskinen)
- Hvad skal jeg pausere? psykofarmakologi.dk crediblemeds.org og cardio.dk
- Hvilke lægemiderl skal jeg pausere ved leverskader? Lægehåndbogen, eller livertox.nih.org (det korte svar – sjældent nødvendigt at tage højde for, heller ikke med paracetamol)
- Fald inducerende lægemidler (data fra uptodate og SST/IRF): polyfarmacy (uanset lægemidler),
- Stoffer, der forværrer ortostatisme: NO donorer, antihypertensiva,
- Stoffer, der slører CNS: Benzodiazepiner, anti-histaminer (og andre stoffer med antikolinerg load), Antipsykotika, Antidepressiva (fx TCA, SSRI m.v), Tradolan (muligt andre morfika ved ubalance i dosering, men ikke så stærk risiko som øvrige stoffer)
- Delir inducerende lægemidler (alle kan, men nogle mere end andre):
- Primær årsag: samme som ved fald (herover)
- Sekundær årsag: Ved AKI: Jf herover, Ved smerter: for lidt smertestillende
- Hvilke lægemidler skal jeg pausere / seponere? – Anvend IRF / SST’s seponeringsliste, eller lignende. IRF og
- Toxicitet og abstinenser (alkohol / benzodiazepiner / morfin): Ikke få ældre har et forbrug de ikke anser for ”alvorligt”. Mange ældre får høje doser morfika / benzodiazepin, og har de ingen til at kontrollere deres compliance, kan variation af dosering ofte forekomme. Nedtrapning af stofferne er som følger
- Benzodiazepiner: Ved anvendelse >4-6 uger anbefales nedtrapning i stedet for seponering. Alt efter halveringstid (type stof) reduceres med 10% reduktion hver anden uge (justeres efter abstinenssymptomer).
- Morfin: I akutmodtagelsen ved påvirket patient, må man reducere ved høj dosis, evt give naloxon. En mere systematisk tilgang er beskrevet i nyligt IRF månedsblad
- Manglende homeostase: Smerte, obstipation, dehydrering, malnutrition (obs re-feeding ved re-ernæring) og nylige sociale ændringer (fx flytning, død i familien m.v), søvnproblemer, abuse- og neglect (fx fra institutioner med tryksår)
- Overvej IV / IM tiamin og b-combin til malnutrition (wernickes encephalopati) – p.o er ved manifest sygdom ikke effektivt
- AKI og præ-renal nyreinsufficiens: http://www.nephrology.dk/Publikationer/DNS%20AKI%20Holdningspapir.pdf
- Ændre din gestalt ved den ældre – Akut tidskritisk sygdom med atypisk præsentation (AKS, hjertesvigt, anæmi, sepsis, AKI m.v): Ændret smertetærskel- og smertefysiologi, “normale” vitalparametre skal fortolkes med omhu, atypiske præsentationer er normale (fx delir, fald, dyspnø med alvorlig underliggende årsag) – disse er bare få af de udfordringer der findes ved diagnosticering af ældre med alvorlig sygdom. For at illustrere hvorfor vores gestalt for præsentationer ved ældre skal ændres ift ved de unge, vil jeg vise et velstuderet område (AKS) og sammenligningen mellem unge og ældre (data fra Nickel et al).
- NSTEMI med brystsmerter: >85 år = 40% Vs <65 år = 80%
- STEMI med brystsmerter: >85 år = 60% Vs <65 år = 90%
- NSTEMI med non-diagnostisk EKG: >85 år = 45% Vs <65 år = 25% (take-home: troponin skal hænge løst)
- LBBB samtidig med STEMI (STEMI-ækvivalent): >85 år = 35% Vs <65 år = 5% (Take-home: kend til STEMI-ækvivalenter, særligt de modificerede sgarbossa kriterier)
Faldgrupper ved håndtering af ældre
- Dekompensering: At gå ud fra, at patienten i delir, eller patienten som falder, ikke har underliggende akutmedicinsk årsag, eller at gå ud fra, at der kun er én årsag til problemet
- Holistisk tilgang til den ældre (Comprehensive Geriatric Assesment (CGA)): At tage en en-dimensionel tilgang til den ældre patient – som Simon Conroy nævnte til DASEM’s årsmøde: hvis du kun finder 1 problem med din [dekompenserede] ældre patient, så skal du lede grundigere (socialt, psykologisk, ADL/funktion (fx ICF modellen), sanser, farmaci, akutte somatiske tilstande m.v). CGA er et værktøj, som har en NNT på 13 (for at undvige unødvendig død eller indlæggelse). Udførelsen er multidisciplinær, og skal udføres igennem hele sundhedssystemet – derfor også i akutmodtagelsen (selvom en hel CGA på alle patienter aktuelt er uopnåelig)
- Overbehandling- og overdiagnostik af frailty patienter: At behandle patienter med svær frailty alene ud fra overlevelse, i stedet for livskvalitet
- Shared decision making: Manglende inddragelse af patientønsker og shared decision making
- Ingen score kan afgøre behandling: At afhænge alene på CFS eller anden score for at træffe beslutninger om behandlingsbegrænsning
- Start low, go slow: Ikke at have kendskab til basal farmakologisk behandling og nedtrapning af ældre – ”start low, go slow” gælder både når man opstarter, og nedtrapper meget medicin (se hvilken på IRF’s seponeringsliste)
- Smerter og delir: Både mangel på smerte-stillende og overbehandling med smertestillende kan give delir. For at afgøre dette kræves der ofte observation. Husk at andre årsager
- Premature closure ved ASB: Det typiske scenarie er plejehjemspatienten med delir uden feber eller smerter, der har grumset- og ildelugtende urin, positiv for leukocytter og nitrit, og måske endda D+R positiv fra urinen. 50% har ASB! – Det er fristende at tro, at dette urinen forklarer hele billedet, men man må 1) udelukke anden årsag til delir (se herunder), 2) udelukke, at der ikke er andre foci for infektion, 3) være konservativ med behandling med antibiotika, for at undgå overdiagnosticering- og overbehandling. Udvikles feber eller andre tydeligere tegn til UVI opstartes behandling selvfølgelig (Nickel et al, 2018)
Håndtering af delir
Du ser mindst én delirøs patient hver dag i akutmodtagelsen (og flere af dem misser du, hvis du ikke screener med delir-screeningsværktøjer. 25% af delirøse patienter udskrives fra akutmodtagelsen). Indlægges delirpatienter har de en mortalitet på 10-25% – udvikles det under indlæggelsen stiger det til 25-75%. Få andre tilstande, som vi potentielt kan gøre noget ved, har så høj mortalitet i akutmodtagelsen. Selvfølgelig er der en hønen-og ægget problematik i denne statistik (er det ikke bare de sygeste, der får delir?). Data tyder dog på, at delir er en individuel risikofaktor for mortalitet (Nickel et al), og opdages det (eller endnu bedre, forebygges det), kan man spare mange QALY (quality adjusted life years).
At skelne mellem delir, demens, depression og defekte sanser (de 4 D’er) i akutmodtagelsen giver ikke mening (demens kan aldrig diagnosticeres akut – kræver 3-6 måneder uden sygdom og alkohol for at kunne vurdere). Karakteristisk for delir er den fluktuerende natur, og deres manglende evne til at holde opmærksomheden (K’et i standardfrasen VKO)).
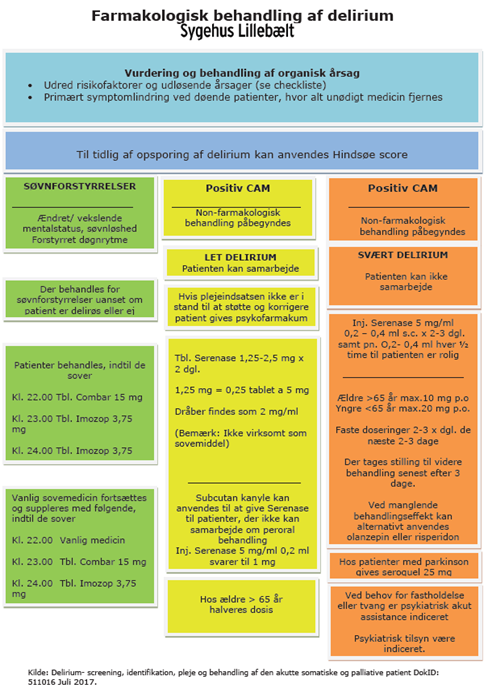
Okay, det er fint nok, men skal de ikke bare have serenase, så hatten passer?…Er du af den holdning, så er følgende det vigtigste du læser i denne uge. Håndtering af de delirøse patienter i 4 punkter:
Step 0
Find de delirøse patienter – mange er ”stille delirøse”, og vil ikke være motorisk urolige. Derfor er screening af alle >65 år nødvendig
Step 1
Find og behandl årsag(erne) = oftest multiple i en “domino effekt” (når en ting vælter, vælter alt)
- Medicinsk (infektion, hypoxi, smerte, obstipation, kSDH, abstinens, dehydratio, hyponatriæmi, m.m)
- Polyfarmaci (antikolinergika, CNS stimulerende m.v – i princippet kan næsten al medicin give delir, og til tider er det nødvendigt og livsvigtigt, at seponere al non-essentiel medicin)
- Søvnproblemer (optimalt: sov om natten, vågen og aktiv om dagen): Ved søvnproblemer giv fx seroquel 25-50 mg eller serenase
- Social (ændring i sociale omstændigheder – fx nylig flytning m.v)
- Forebyggende (geriatric friendly Emergency Derpartment):
- Optimer sanser: find høreapparat, briller m.m
- Optimer væske- og mad indtag
- Undgå obstipation (behandl profylaktisk med laxantia ved obstiperende medicin fx morfin)
- Undgå støj, lys på natten
- Tidlig mobilisering
- Undgå unødige overflytninger / ændring af rum
- Få om muligt pårørende med i forløbet og placer familiære ting på stuen
Step 2
Håndter basale behov / non-farmakologiske behov (ernæring, orientering- og kognitiv stimulation, motion/mobilisering, sanseoptimering og døgnrytmeoptimering)
Step 3
Evt antipsykotisk behandling: kontroversielt og anvendes primært ved
- Delir med svær psykomotorisk uro (ofte forebyggeligt pga manglende ressourcer til håndtering af punkt 2 – https://www.bgs.org.uk/blog/do-antipsychotic-drugs-have-a-role-in-the-modern-management-of-delirium
- Delir med svær psykomotorisk uro (ofte forebyggeligt pga manglende ressourcer til håndtering af punkt 2 – https://www.bgs.org.uk/blog/do-antipsychotic-drugs-have-a-role-in-the-modern-management-of-delirium
- Delir med svære døgnrytme problemer: Man kan evt anvende understående lommekort-vejledning fra Sygehus Lillebælt fra eller SST’s anbefalinger
Step 4
Hvis patienten IKKE har rettet sig på step 1-3 behandling indenfor kortere tidsrum (Fx 3-4 dage), overvejes propofol sedering eller ECT behandling (igen – delir er en livstruende tilstand og ECT er en skånsom behandling ift meget antipsykotika. Vi skal generelt blive bedre til at anvende ECT på delir-indikation)
Håndtering af fald
ved fald hos ældre, må man tænke på 1) var det et fald eller ikke (en stor del af ældre, der falder, har i virkeligheden synkoperet!), 2) faldkomplikationer (blødninger, fraktur, rhabdomyolyse m.m), 3) årsagen til faldet (dekompenseringssyndrom? – overvej årsager som ved delir) og 4) Reduktion af risiko for nye fald (GCA og opfølgning).
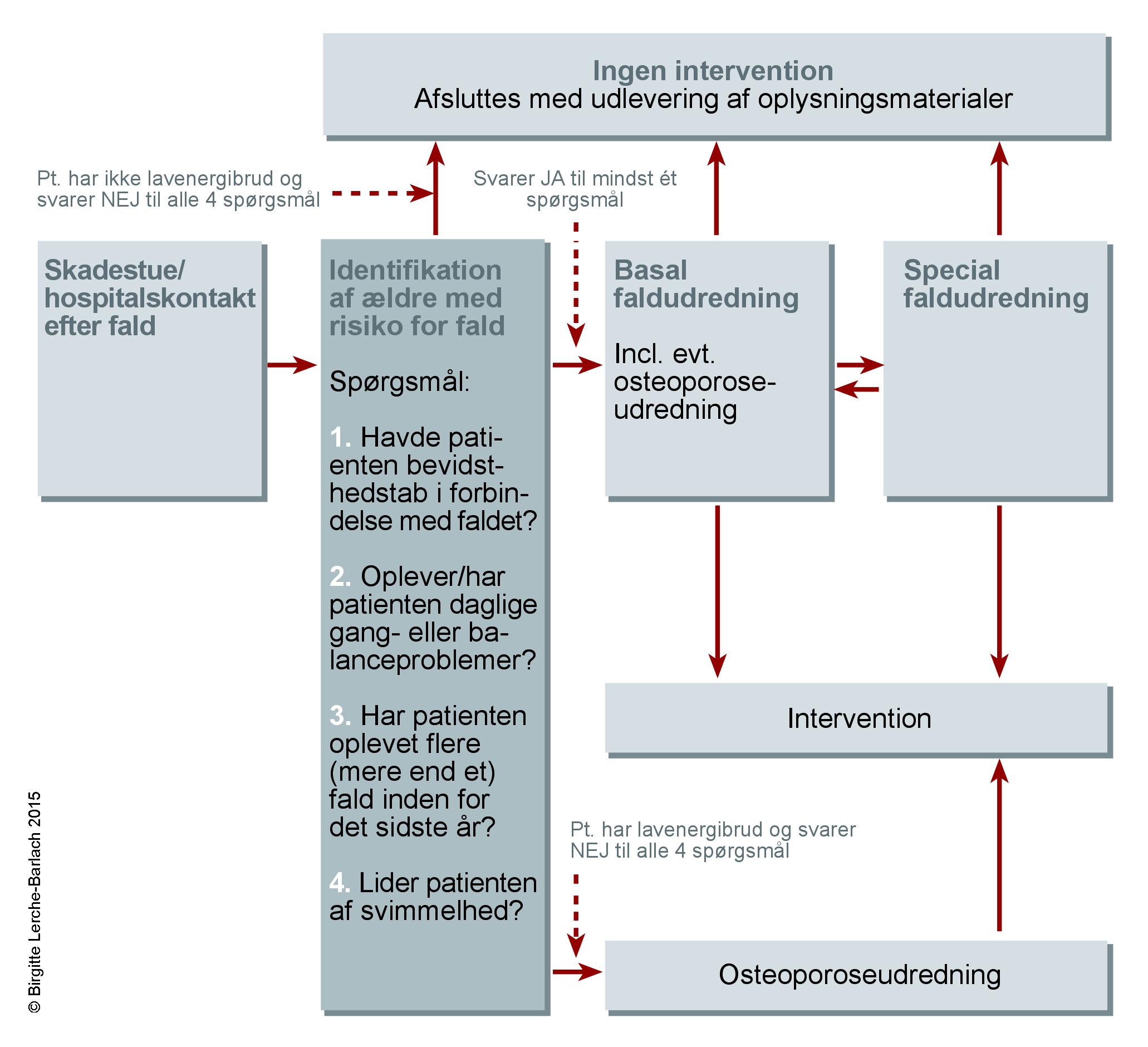
Følgende er en detaljeret gennemgang
- 0) Fald eller anden diagnose?
- Fald: Fald ved ældre patienter er som udgangspunkt symptom på en underliggende tilstand, eller lidelse (jf punkt 1)
- Synkope / epilepsi: ofte behøves proxy-anamnese fra vidner (kontakt pårørende, plejehjem, ambulance personale) – patienter vil ofte forsøge at efterrationalisere ”jeg må jo være faldet, og ikke besvimet fordi…”. Hvis dette ikke kan skaffes- eller den er insufficient, må man udføre en risikobedømning ift mistanke af kardiogen årsag (jf tabel herunder inspireret af ESC 2018 synkope-guideline og uptodate). Epilepsi mistænkes særligt ved samtidig laterale tungebid, post-iktal fase, fæces- og/eller urinafgang
- 1) Hav holistisk tilgang (anvend evt hele eller dele af CGA) –
Find og behandl årsag(erne): start med de tidskritiske alvorligste årsager
først
- Medicinsk (infektion, hyponatriæmi, AKI / dehydratio, smerte, sarkopeni, obstipation m.v)
- Polyfarmaci- og intoxication
- Alkohol- og abstinens
- Alvorlig ortostatisme
- Delir
- Neurologi:
- Stroke? (som udgangspunkt bliver man ikke transitorisk bevidstløs af stroke – vil strokepatienten med fald, ofte have svært at komme op fra gulvet og have ligget der længe)
- Oto-neurologiske svimmelhedsdiagnoser
- Ubalance og evt polyneuropati
- 2) Identificer tilstødende komplikationer til faldet:
- Fraktur (særligt ryg- og hoftefrakturer)
- Smerter og obstipation som følge af morfika
- Delir som følge af underbehandlet/overbehandlet smerter i forbindelse med faldet.
- kSDH
- Rhabdomyolyse
- Compartment syndrom
- 3) Når ovenstående er afklaret bør der overvejes følgende ved:
- Stabil patient, uden klar faldårsag som er oppegående, og uden mistanke om synkope: Patienten bør henvises til ambulant udredning mhp at finde den/de udløsende agens, samt for at optimere patientens situation mhp at forebygge flere faldepisoder.
- Ustabil/uafklaret patient- eller ikke-mobiliserbar patient: Bør indlægges til videre behandling og udredning, samt stillingstagen til aflastning. Ved mistanke om kardiogen synkope, til TnI / EKG og telemetri. Der bør hurtigt i forløbet tages stilling til behandlingsniveau og genoplivning (LINK til EOL samtalen).
- 4) En oversigt over ætiologien samt overvejelser i forbindelse med faldudredning i akutmodtagelsen, kan fås i denne infographic der blev præsenteret på DASEMs årsmøde 2019: https://my.visme.co/projects/1jomg8dw-a-doctors-call-to-fall?fbclid=IwAR2JzDZnkBvDRzlKjiNaEjQa4znJAUkoYTYZxhyO-q3wUeRjNBV1CLX0WCI
| Høj risiko (major) | Høj risiko (minor) | Lavrisiko | |
| Baggrundsinformation |
–
Demografi: ældre frail og unge med særlig anamnese* – Tidligere: svær strukturel- eller iskæmisk hjertesygdom (hjertesvigt med lav EF, tidl AKS) |
–
Dispositioner: pludselig tidlig død i familien – Medicin: faldtendens og blodfortyndende behandling |
–
demografi: unge uden særlig anamnese – Tidligere: årelang tendens til (stereotype) synkoper med lav-risiko anfaldsanamnese (se herunder); fravær af strukturel / iskæmisk hjertesygdom |
| Anfalds anamnese |
– Prodrom:
pludseliget nytilkommen dyspnø, smerter (brystsmerter, hovedpine,
mavesmerter) eller palpitationer – Trigger: under fysisk aktivitet eller i liggende stilling |
– Prodrom:
ingen eller meget kort (jf kardiogen årsag, tabel 2) – Trigger: siddende stilling – Gentagne synkoper / tiltagende frekvens – Lang postiktal fase (jf obs epileptisk eller komatøs årsag) |
– Prodrom:
typiske reflekssynkope symptomer (svimmelhed, kvalme m.v) – Trigger: situationsbetinget ved typiske refleks- eller ortostatiske årsager (jf tabel 2) – evt ved hovedrotation (sinus carotis syndrom), eller under / lige efter måltid |
| Objektiv undersøgelse |
–
Vitalparametre: uforklaret blodtryk <90 mmHg, vedvarende bradykardi <40
i vågen tilstand (uden at patienten er maratonløber / fit) – Tegn på GI blødning (hæmatemese, blod per rektum etc) – Nyopdaget systolisk mislyd – Neurologiske udfaldssymptomer |
–
Vitalparametre: feber – Almen tilstand: komotioneret, konfus | Uden fund |
| EKG |
–
Iskæmitegn – alvorlige bradykardier (fx mobitz type II eller 3.grads AV blok) eller frekvens <40 (+/- atrieflimmer) – alvorlige takykardier (fx VT, brugada, WPW med atrieflimmer) – Andet: Pacemaker dysfunktion, QTc >460 ms | ** – Mildere bradykardier (fx mobitz type I) eller frekvens 40-50 – mildere takykardier (SVT og atrieflimmer) – andet: QTc <340 ms m.v | Normalt (evt serielle) EKG’er og/eller telemetri |
| Øvrig paraklinik |
Tegn på alvorlig
medicinsk årsag (jf krampeårsager, blødningsårsager, neurologiske årsager
tabel 2) Tegn til alvorlige faldkomplikationer (jf senere) |
Risikostratificering af synkopepatienter. Adapteret med få
modifikationer fra ESC 2018 synkope guidelinen, cardio.dk og uptodate.
*familiær disposition med tidlig / pludselig død, nylig fødsel, misbrug af
centralstimulantika,
** Bliver majorkriterier, hvis findes sammen med kardiogen anfaldsanamnese
Take home
- Vi skal ALLE hjælpe til for at optimere forholdende for patienten med høj biologisk alder (frail)
- Atypiske præsentationer (fx AKS med dyspnø, svimmelhed eller almen utilpashed som præsentationssymptom) er typiske ved ældre
- Vitalparametre og triage-systemerne undertriagerer ældre patienter:
- CFS (comprehensive frailty score), CAM-scoren, vurdering af ADL / præ-morbid status og walk’n’talk er vigtige dele af undersøgelsen af den ældre patient i akutmodtagelsen
- Har patienten høj CFS, bør man nøje overveje konsekvenser af diagnostik og behandling er overensstemmelse med patientens ønske- og hvad der giver mest mulig livskvalitet for dem, snarere end rent overlevelses-fokuseret behandling
- Ældre fraile patienter bliver ikke ”bare” delirøse eller ”falder bare” fordi de snubler: Fald, delir, manglende evne til at gå og uspecifikke symptomer (Non-specific symptoms ??) er ofte en ”dekompensering” af en geriatrisk skrøbelig patient.
- Patienter der ikke tidligere er kendt med frailty, men pludseligt begynder at falde, skal følges op (lægehåndbogen)
- De fleste ældre har tænkt over slutningen af deres liv, og hvordan det skal foregå. Opstart gerne behandlings-grænse- og EOL (end of life) samtaler i akutmodtagelsen (plant et frø – du behøver ikke afslutte samtalerne)
Kilder/ressourcer
- Generelle kilder
- Nickels og Conroy et al, 2018: Geriatric emergency medicine
- The silver book: https://www.acutefrailtynetwork.org.uk/uploads/files/1/Resource/SILVER_BOOK_FINAL_MAIN.pdf (gratis e-bog om geriatrisk akutmedicin i Storbritannien)
- AcuteFrailtyNetwork.org.uk
- 5 fingers model: https://britishgeriatricssociety.wordpress.com/2017/10/13/the-geriatric-5ms-the-5-simple-words-every-geriatrician-needs-to-know-the-new-mantra/
- Videnscenter for demens
- Uptodate: Hospital management of older adults (https://www.uptodate.com/contents/hospital-management-of-older-adults )
- Care of the Older Adult in the Emergency Department: Nurses Views of the Pressing Issues (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3635857/ )
- Internationale akutmedicinske guidelines
- Polyfarmaci
- DSAM (dansk selskab for almen medicin): den geriatriske patient guideline
- IRF’s medicingennemgangsmodul
- IRF’s seponeringsliste
- Interaktionsdatabasen
- Medstopper.com
- Fald
- Lægehåndbogen: fald patienten
- Retiring the term “mechanical fall” for older patients: https://gempodcast.com/2018/11/09/retiring-the-term-mechanical-fall-for-older-patients/#more-611
- Frailty
- Using frailty index in the ED: https://www.bgs.org.uk/blog/using-a-frailty-index-in-the-emergency-department
- Clegg et al, 2013: Frailty in elderly people (https://www.ncbi.nlm.nih.gov/pubmed/23395245 )
- Delir:
- Videnscenter for demens: http://www.videnscenterfordemens.dk/pleje-og-behandling/pleje-og-omsorg/fysisk-pleje-og-omsorg/delir-aarsager-behandling-og-forebyggelse/
- BPSD
- Smerte
- FANTSASTISK ressource fra SST: https://www.sst.dk/da/rationel-farmakoterapi/smerteindsats
- FOAMed
- Blog om geriatri
- BGS (British Geriatric Society): https://www.bgs.org.uk/blog
- Blog om geriatri
- Billeder
- Egen produktion og Clegg et al (reference herover)
- Sygehus Lillebælt delir guideline