Tredje patient: Pancytopeni
Case beskrivelse: på en nattevagt på et mindre sygehus er din næste patient en 57 årig tidligere rask mand, som søger med sår på benet, feber og makroskopisk hæmaturi. Din hæmatologkonsult er gået i seng . Standard blodprøver viser Hgb 5,6; Leukocytter 4, Trombocytter 11, krea 250, CRP 250, feber 38,3. Patienten er subfebril, men ellers stabile vitalparametre. Hvad er dine differentialdiagnoser? Hvordan vil du komme videre med dem?
Håndtering: Patienten har definitorisk pancytopeni, med infektionsmistanke og nyresvigt. Patienten kan have flere ting på en gang (hiccams dictum) eller en forenende diagnose (orchams razor). Ud fra den sparsomme information bør man på akutmodtagelsen som akutmediciner i hvert fald overveje akut leukæmi (herunder APL med DIC), neutropen feber, Tumor lysis og TTP.
Du gør følgende
- Infektionsudredning- og empirisk behandling: Gennemdyrkning og opstart af sepsis behandling på klinisk mistanke om neutropen feber (alt efter hvor hurtigt du kan få neutrocytter tilbage)
- AKI behandling: Pausering af nefrotoxisk medicin, Blæreskanning (obs post-renal årsag), IV væske
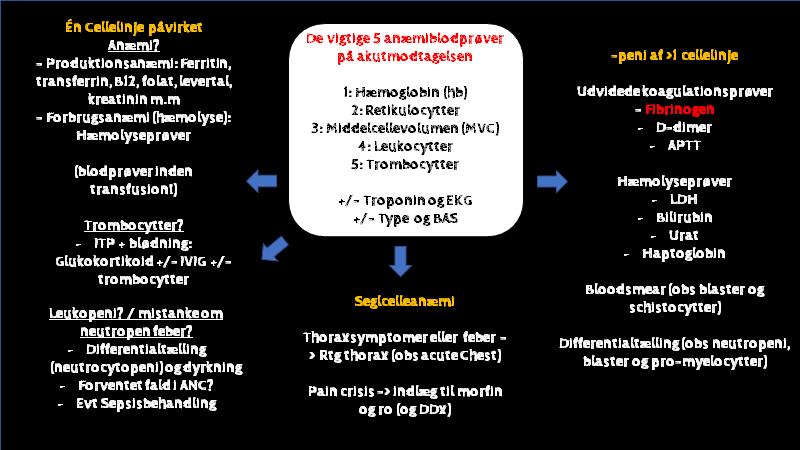
- Udredning med med udvidede koagulationsprøver obs DIC (APTT; Fibrinogen, D-dimer, INR), hæmolyseprøver obs MAHA (LDH, Haptoglobin, blood-smear obs schistocytter) og udvidet anemiprofil (inkl Differentialtælling obs promyelocytter og neutropeni), og EKG / troponin pga Hb indenfor transfusionsgrænsen ved iskæmi
Du får de udvidede koagulationsprøver tilbage med APTT 28 (ref: 20-30), INR 1,4, D-dimer >30, fibrinogen 1,2 (ref: 2-4). Neutrocytter 2. Bloodsmear kommer ikke endnu. Troponin 8, EKG uden nytilkommen iskæmi.
Som jeg har forklaret i mange tidligere blogs, så handler akutmedicin ikke om at behandle den diagnose som er mest sandsynlig, men snarere om at opstarte behandling på tidskritiske “syndromer” med høj nok post-test sandsynlighed (særligt hvis behandlingen er reversibel / ufarlig / ikke hindrer øvrig differentialdiagnostik).
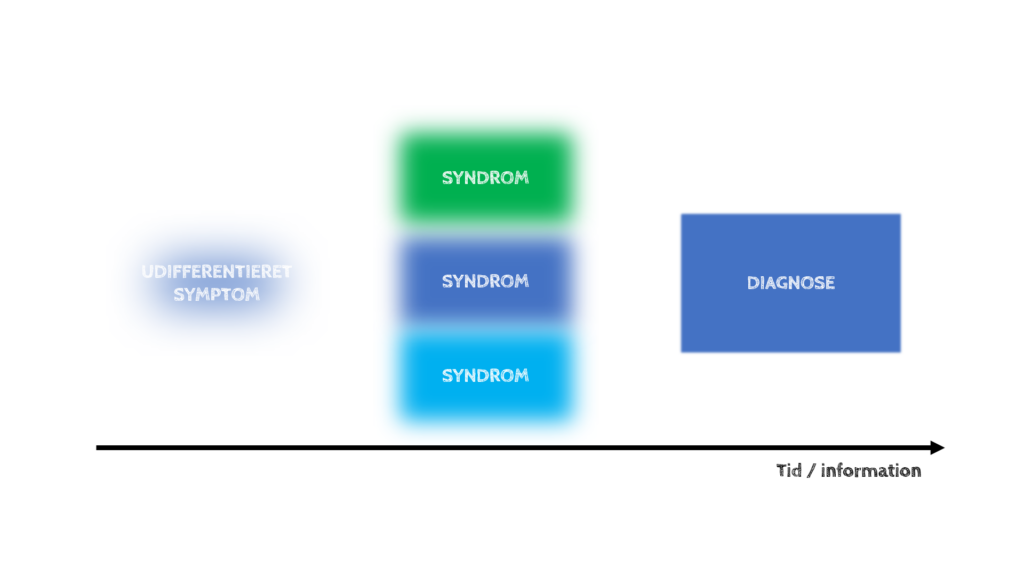
I akutmedicin kommer vi sjældent hele vejen til højre i billedet herover (og dette er ikke meningen heller), og alt efter hvor stabil patienten er, kan vi behøve at behandle på forholdsvist “umodne” syndromer (med enten meget støj eller få datapunkter)
Vi vil ikke have rigtig diagnose – vi vil have ret i øjeblikket med de data som var til rådighed i det system / kontekst vi arbejdede i
Man kan lave lister over differentialdiagnoser på forskellig måde – der findes:
- Possibilistiske liste: En listning af alle “mulige” differentialdiagnoser ud fra pågældende præsentation, uden stillingtagen til hvad der er mest sandsynlig (en teknik som kan anvendes af helt nye læger / studerende, eller hvis man er på bar bund over en udredning af en patient, trods mange tests allerede er udført). Generelt er denne metode ikke effektiv- eller økonomisk
- Probabilistisk liste: En listning af mulige differentialdiagnoser ud fra den bedømte præ-test sandsynlighed, uden skelnen mellem tidskritiske og ikke-tidskritiske tilstande.
- Akutmedicinsk probabilistisk liste: Som probabilistisk liste, men med opdeling i tidskritiske- og ikke tidskritiske tilstande
- Prognostisk liste: Liste med alene de tidskritiske tilstande
- Pragmatisk liste: Liste med den tilstand, der er mest behandlingsbar
Indenfor akutmedicin bør vi lave en “en akutmedicinsk probabilistisk liste”, hvor man ikke alene medtager de mest sandsynlige diagnoser, men også overvejer fx de 3 mest sandsynlige tidskritiske tilstande. I dette tilfælde kan vi illustrere dette således
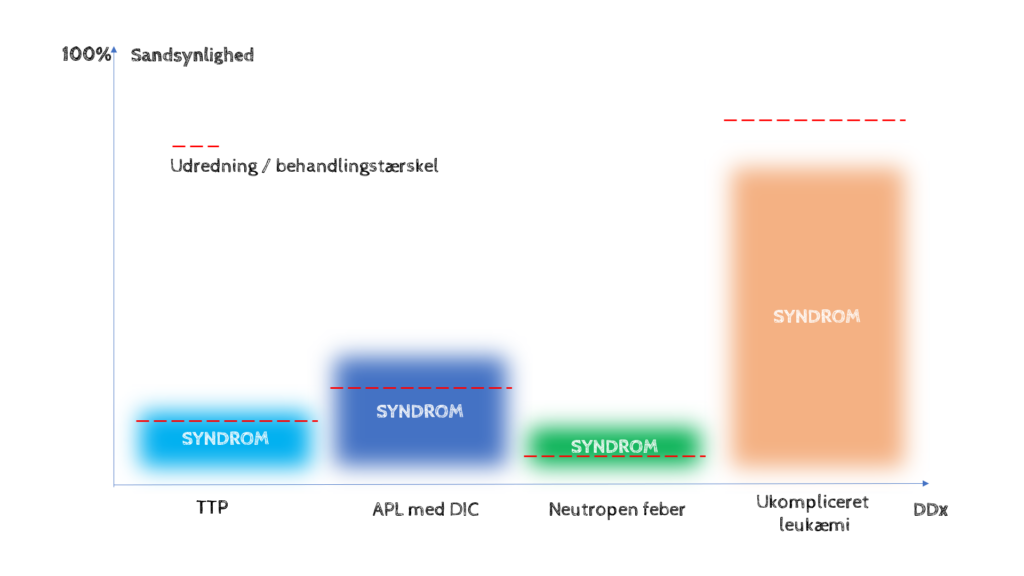
Sandsynligheden for at denne patient fx bare er dehydreret og derfor AKI og har feber sekundært til enten B12 mangel eller leukæmi eller anden mere benign årsag til pancytopeni , er mest sandsynlig (fordi det er hyppigst). Imens er de mere alvorlige syndromer som vi tænker på betydeligt mindre sandsynlige, men til gengæld farligere. Vores tærskel for at udrede- og behandle er altså lavere for disse tilstande. Dette er hvad der pågår i hovedet på akutmedicineren. Ikke sjældent kan man dagen efter i retrospektoskopet (når mere viden er indsamlet og man er nærmere diagnose) måske få at vide, at det var enormt usandsynligt at udrede / behandle for disse relativt sjældne syndromer (og hvorfor man dog opstartede antibiotika i stedet for at vente til prøverne kom) – men på tidspunktet var de bedømt som sandsynlige, og at vente ville have været problematisk.
Okay – lad os gå videre med casen:
Hvilke alvorlige tidskritiske tilstande (og syndromer) kan mistænkes?
Inden vi stirrer os blindt (anchoring) på alle de skæve blodprøver, så skal vi håndtere de basale tidskritiske syndromer
- Sepsis (opstartet i empirisk antibiotika)
- AKI (behandlet indtil videre)
- Type II infarkt (udredt)
- Trombocytopeni (ingen blødning, og kan vente med transfusion indtil hæmatolog konsultation)
Okay, nu kan vi gå til de åbenlyst patologiske blodprøver, og deres differentialdiagnoser. Patienten har per definition pancytopeni. Hér skal akutmedicineren i hvert fald tænke på følgende to differentialdiagnoser
- TTP (eller anden TMA)
- APL med DIC

Her når vi til det jeg kalder en “skillevej” (Crossroad) i vores syndromhåndtering. Skillevejen opstår fordi disse to diagnoser har vidt forskellig behandling (og til tider i andre scenarier direkte modsatrettet behandling – fx LE Vs aortadissektion hos patient man overvejer at trombolysere). Vi kan i disse skillevejs-situationer gøre to ting:
- Behov for mere data: Find mere data (fx ved at lave en test, der kunne skelne mellem dem), med risiko for at slørre billedet endnu mere, hvis testen ikke har god LR
- Forstå den data vi har: Forsøg at forstå den data vi har indsamlet (fx ved at spørge ekspert), herunder genovervejelse af præ-test sandsynligheden (for med system2 tankegang at forsøge at komme mest sandsynlig diagnose nøjere). Dette kaldes til tider et “stop og tænk” i den diagnostiske process.
Disse to diagnoser har altså vidt forskellige behandlinger – og behandlingen for den ene er ikke godt for den anden tilstand. Derfor kan vi ikke bare behandle begge og vente på definitivt svar (bloodsmear og differentialtælling). Desuden er begge tilstande hyperakutte, og kræver håndtering inden definitiv diagnose .
I dette tilfælde vil jeg argumentere for, at det ikke er mere data, men at forstå den data vi har foran os, som er vigtigt:
Som udgangspunkt vil patienten med TTP eller en af de andre TMA-spektrum sygdomme (Trombotiske mikroangiopatier fx HELLP, Hæmolytisk uræmisk syndrom etc) være akut dårlig og gerne agiteret eller GCS <13-15. Ud fra historien er APL derfor mere sandsynlig end TTP.
Ovenpå det, er blodprøvebilledet stærkt tydende på APL med DIC:
Kombinationen af høj D-dimer og lav fibrinogen gør, at APL med DIC skal mistænkes kraftigt og du tager akut kontakt med hæmatolog med henblik på overflytning og opstart af APL behandling. Efterfølgende kommer promyelocytter i din differentialtælling.
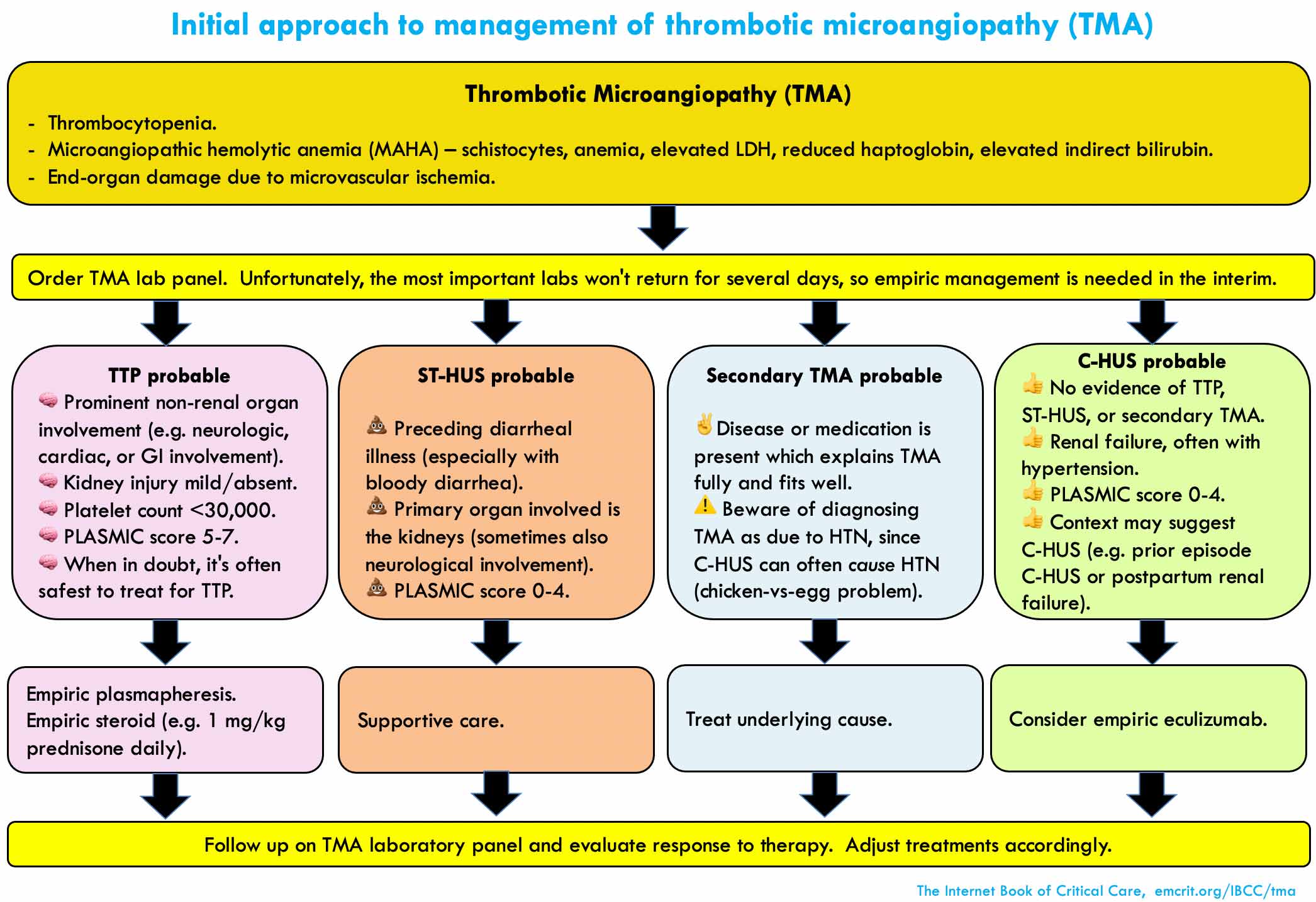
TMA og TTP
TMA er en fællesbetegnelse for trombotiske mikroangiopatier, som er akutte koagulopati-tilstande, der giver mikroskopiske tromber i endeorganer (hjerne, nyre, hjerte, fingre etc), hvorfra symptomerne opstår. TMA’er som som akutmedicineren skal kunne genkende og behandle initialt er
- HUS (Hæmolytisk uræmisk syndrom) og dens spektrum sygdomme (aHUS: atypisk HUS)
- HELLP (Hæmolyse og eleverede lever enzymer og lave blodplader) under graviditet med præeklampsi
- TTP (Trombotisk Trombocytopenisk Purpura)
- Øvrigt (ej gennemgået her): Antiphosphorlipid syndrom med eller uden SLE (Systemisk Lupus), Malign hypertoni, Svær infektion og malignitet
Dette felt er enormt heterogent, og overlapper med andre diagnosegrupper, hvorfor jeg ikke ønsker at gå i detaljer, da dette er mindre relevant for akutmedicineren.
For akutmedicineren er det vigtigere at vide, hvornår vi skal få mistanken, og hvordan vi skal gå videre med denne mistanke.
Hvornår skal TMA mistænkes?
Ifølge Hæmatologisk professor Dr Tom DeLoughery er vi nødt til at have en lav tærskel for at udrede en dårlig patient med uforklaret trombocytopeni for disse tilstande. For HELLP kræves en gravid- eller post-partum kvinde med præ-eklampsi symptombillede. Ved HUS vil der ofte (men ikke nødvendigvis) være diaré og gastroenterit symptomer i historien.
Fælles for alle TMA tilstande er, at de har MAHA (mikroangiopatisk hæmolytisk anæmi), og dette kan vi finde på blodprøver. MAHA er en non-immunologisk hæmolyse (modsat DAT-positive hæmolytiske tilstande fx AIHA: Autoimmun hæmolytisk anæmi), der resulterer i at trombocytter ødelægges hvilket giver ødelagte trombocytter (schistocytter) på et bloodsmear. Dette kan ske ved en række tilstande herunder fremmedelegemer i blodsystemet fx mekanisk hjerteklap, DIC, toxiner, traume, visse drugs og sygdomsprocesser.
Således:
- Ved mistanke om TMA (dårlig patient fx med sepsisbillede / stroke og med uforklaret trombocytopeni): Tag bloodsmear (obs schistocytter), og Hæmolytiske anæmiprøver (De 5 + Haptoglobin, LDH, bilirubin). Dr De DeLoughery anbefaler, at vi særligt fokuserer på uforholdsvistmæssig høj LDH (>500-1000) i kombination med schistocytter
- Ved kvinder i fødedygtig alder: Tages uHCG, urin-stix og Blodtryk (obs præ-eklampsi)
Hvordan skal vi gå videre når mistanken forefindes?
HELLP er lettere at opfange, da tilstanden foregår i den gravide- og post-partum patienten kan simple blodprøver give dig mistanken: Anamnese og præ-eklampsi symptomer, samt Præ-eklampsi udredning (u-hCG og u-protein) og BT-måling. sidenhen: anemi- og leverprøver, samt koagulationsstatus får dig på sporet. Udfordringen ved HELLP i denne kontekst er, at den gravide patient både få DIC og TTP også.
TTP og HUS nævnes ofte i samme åndedræt pga deres lignende blodprøve billede. Dr DeLoughery fortæller os i stedet for den klassiske ”pentade” for TTP (feber, trombocytopeni, anæmi, AKI og neurologiske symptomer – pentaden er uspecifik fx vil kun 50% præsentere med feber, og kun 30% have hele pentaden) om en lettere ”terrible triangle”-metode
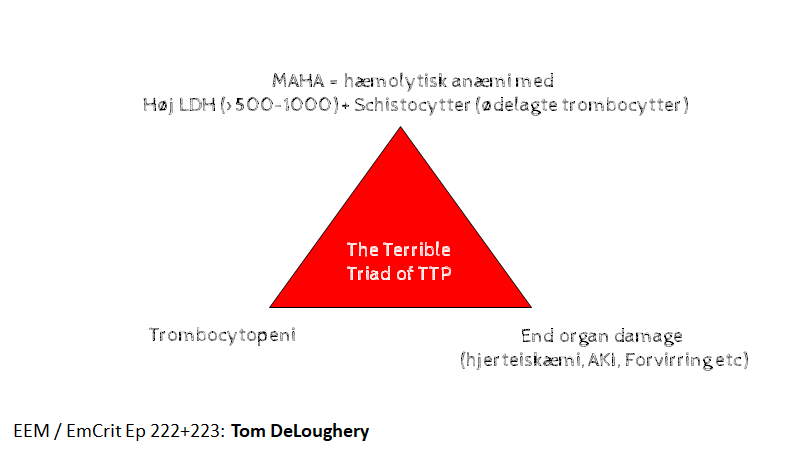
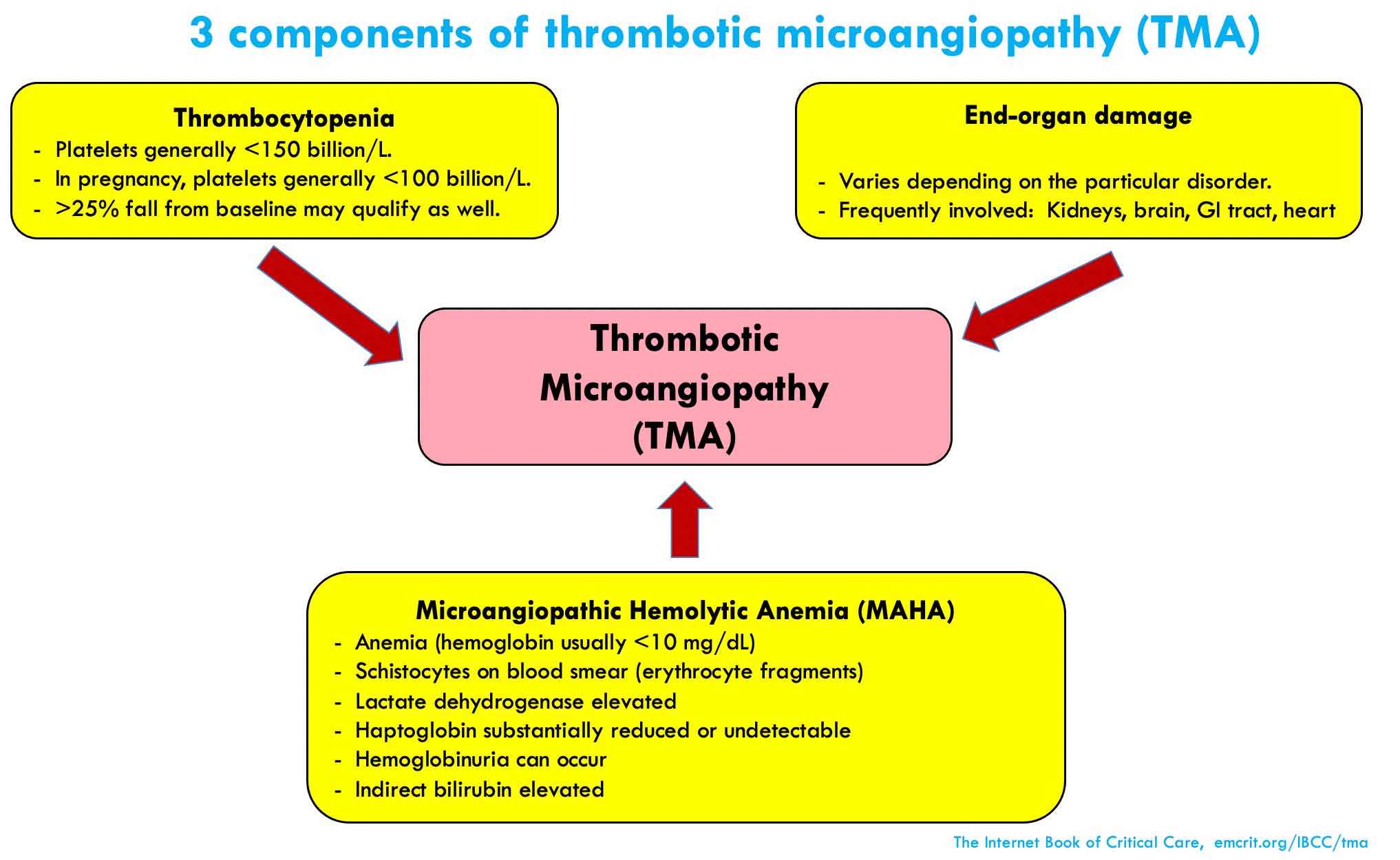
TTP og HUS kan nu forstås som et spektrum, hvor fællesbetgenelsen er TMA (tromboctic microangiopathy). Når vi ser at begge tilstande har MAHA og trombocytopeni, er det, der adskiller dem fænotypisk deres ”end organ damage”. HUS har ofte større nyrepåvirkning, og TTP mere hjernepåvirkning, men begge kan have multiple ende organ skader (fx vil TTP have nyreskade, og HUS kan have tromber i hjernen).
Behandlingen
- HELLP: Alt efter alvorlighed og mistanke om DIC. Konsulter med gyn/obs. Ofte kombination af præ-eklampsibehandling (antihypertensiva), observation af foster og moder og/eller ”få barnet ud”
- TTP: Plasma exchange (specialist center) – I transporttid til center kan overvejes: FFP bolus x2 og herefter hver 6. time +/- glukokortikoider (CAVE: trombocytter)
- HUS: behandl AKI aggressivt, og symptomatisk behandling -peni’erne (må gerne få trombocytter hvis nødvendigt) -> dialyse (plasma exchange har ikke samme evidens som ved TTP)
APL med DIC
DIC (disseminieret intravaskulær koagulopati) er et symptom på underliggende sygdom, og ikke en selvstændig diagnose. Derfor skal man altid ved et blodbillede, der tyder på DIC udrede for- og behandle underliggende årsag. Diagnosen DIC er en blanding af klinik og blodprøve billede og ingen test er patognomisk, men kombinationen af ekstrem høj D-dimer (fx >30) samtidig med fibrinolyse (fibrinogen <1,5 g/L) og underliggende akut sygdom (sepsis, APL etc) er formentlig ganske sensitivt (dog ikke specifikt). Jo mere ekstremt billede, des mere sandsynligt.
Der findes kronisk DIC , men her koncentrerer vi os om akut DIC.
akut DIC er karakteriseret ved fibrinolyse. Selvom ingen af os husker koagulationskaskaden (og endnu færre forstår den), så kan vi stadig forstå nogle vigtige pointer om kaskaden, som vi kan anvende klinisk. Fibrinogen er den sidste aktør i den trombotiske kaskad, således at hvis den ikke fungerer, så er det ligemeget, hvor meget ”kul” der fyldes på bålet i form af pro-trombotiske faktorer – der kommer ikke flere klots, når fibrinogen er opbrugt. Når Fibrinogen fungerer normalt, kløves det af trombin til fibrin og sidenhen til klotting faktorer.
D-dimer er et mål for fibrin (ikke fibrinogen), og således en (uspecifik) indikator for klotting, og vil stige enormt ved fibrinolyse under akut DIC.
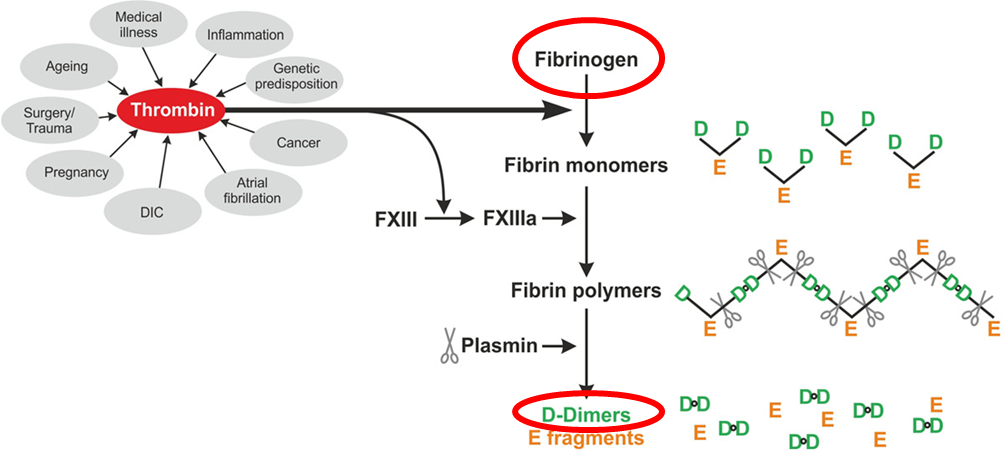
Ved akut DIC opbruges fibrinogen (øverst), således at målt fibrinogen i blodet er lavet, og nedbrydningsproduktet fra fibrin (d-dimer) stiger (ofte voldsomt). Dette er 2 af de vigtigste blodprøve karakteristika ved DIC
Ved DIC sker der en hyperaktivering af fibrinogen (fibrinolyse) forårsaget af den underliggende årsag (sepsis, traume etc). Dette vil opbruge fibrinogen og skabe mikroklotting (som klinisk kan ligne TMA – se herover). I højere grad vil DIC dog præsentere med blødning (purpura og organblødning), da forbruget af fibrinogen tager slut, og skaber en massiv blødningstendens (fordi man ikke kan klotte effektivt uden fibrinogen), som ofte er mere dominerende i symptombilledet end cloting.
DIC skelnes fra TMA ved at TMA generelt har normale koagulationstests, og særligt ikke har fibrinolyse (Høj D-dimer, Lav fibrinogen)
Særligt for den aktuelle case, har patienten en pancytopeni, hvilket giver os mistanke om leukæmi. Den eneste leukæmi akutmedicieneren behøver kende til, er APL: akut promyelocyt leukæmi, da de har en høj risiko for at DIC’e med intrakraniel blødning og høj mortalitet (selv ved unge) til følge.
Opstart af APL behandling skal derfor ske inden diagnosen endeligt kan nærmes / stilles (ved knoglemarvsbiopsi, bloodsmear og/eller differentialtælling).
Som akutmediciner midt om natten er du derfor nødt til at kende til hvad du skal bestille når du får en patient med mistanke om leukæmi: Fibrinogen og D-dimer (samt de øvrige koagulationsprøver). Så snart disse svar kommer tilbage, konsulteres med hæmatolog mhp overflytning og akut opstart af retinoid syre.
I mellemtiden kan det være nødvendigt at behandle DIC symptomatisk.
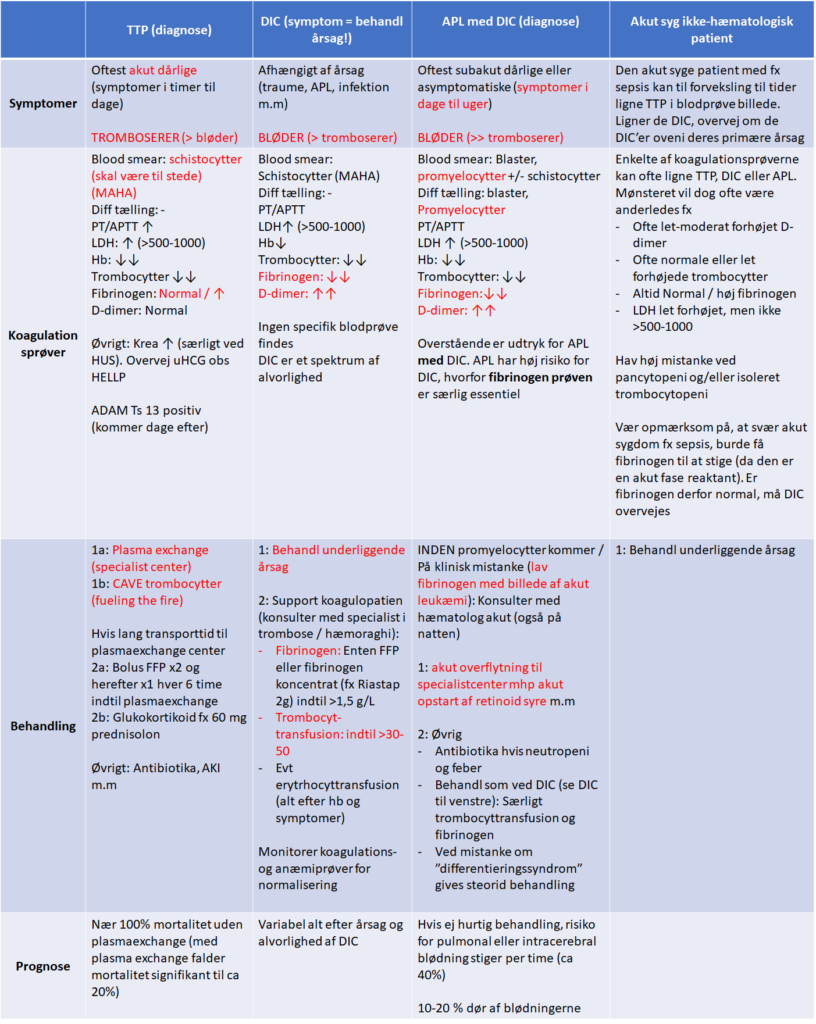
En sammenfatning af overstående findes i denne tabel:
Bottom line
- Pancytopeni er defineret ved nedsat funktion af alle 3 cellelinjer (hb, trombocytter og leukocytter). En patient kan have funktionel pancytopeni hvor den ene cellelinje (oftest leukocytter) er høj, men ikke har deres normaleffekt.
- Som udgangspunkt kræves akut udredning ved uforklaret -peni af >2 cellelinjer
- Udredningen skal gøres på akutmodtagelsen og indefatter mindst: 1) Differentialtælling (obs neutropeni, promyelocytter og blaster), 2) Udvidet koagulations status obs DIC og TMA: APTT, INR, Fibrinogen, D-dimer (særligt fibrinogen er vigtig og glemmes ofte), 3) Bloodsmear (obs schistocytter), 4) Ofte udvidet anemiprofil (se anæmi-case herover)
- Årsager til pancytopeni er mangfoldige og spænder fra B12 mangel til hæma-onkologiske tilstande. For akutmedicineren er det vigtigst at vide, om der skal gøres noget nu, og derfor er APL, DIC og TMA’erne (særligt TTP og HUS) vigtige at kende til som illness scripts.
- På akutmodtagelsen er den vigtigste opgave ved pancytopeni at: 1) Udelukke APL / DIC og TMA’erne, 2) Vurdere behov for antibiotika, 3) Sende videre for relevant udredning
- APL med DIC udelukkes for praktiske formål ved normal fibrinogen og D-dimer (ej tegn til fibrinolyse). Ved tvivl konsulteres (også nattetid) akut med hæmatolog om fortolkning af koagulationssvaret og om patienten skal overflyttes akut til opstart af behandling.
- TTP patienten er ofte akut dårlig (oftest modsat APL med DIC), og har ikke tegn til fibrinolyse på blodprøvebilledet. Indtil patienten kan komme til et plasmaexchange-center gives FFP. Trombocytter er som udgangspunkt kontraindicerede (“fueling the fire”)
- Er APL og TMA udelukket, kan patienten ofte vente på videre hæmatologisk udredning i dagtid
Ref
- https://www.hematology.dk/index.php/vejledninger/kliniske/2012-11-06-06-19-25/279-modtagelse-af-akut-leukaemi/file
- https://kunskapsbanken.cancercentrum.se/diagnoser/aml/vardprogram/akut-promyelocytleukemi-apl/
- http://www.emdocs.net/hemolytic-anemias-rare-important-diagnosis-emergency-department/
- https://emcrit.org/emcrit/ttp-dic-1/ (EmCrit Ep 222+223)
- https://www.uptodate.com/contents/approach-to-the-patient-with-suspected-ttp-hus-or-other-thrombotic-microangiopathy-tma?search=Thrombotic%20microangiopathy&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1#H3583816
- https://emergencymedicinecases.com/ttp/
- EmCrit IBCC: https://emcrit.org/pulmcrit/tma/ + https://emcrit.org/ibcc/tma/